
【专题网络研讨会预告】

【详情及报名方式见文末】
2017年5月5日,欧盟发布了新的医疗器械法规(Medical Device Regulation,以下简称MDR),编号为2017/745,以取代原有指令,通过MDR认证的产品将贴上新的CE(欧洲合格评定)标志。法规的更新使出海欧盟的医疗器械企业面临更加复杂的境况。

在MDR生效之前,所有进入欧盟市场的医疗器械均需遵守医疗器械指令(MDD)和有源植入医疗器械指令(AIMDD),并根据其要求进行产品合规性评估,获取CE认证。
MDR认证的复杂性则为出海欧洲的医疗器械品牌带来更多挑战,此前已通过MDD/AIMDD并获CE认证的企业与产品同样需要按照MDR要求更新认证:


【欧盟医疗器械法规(MDR)过渡期的规定与延长】
欧盟医疗器械法规(MDR)2021年5月26日生效,过渡期为3年。根据规定,截止2024年5月26日前,获得CE认证的医疗器械产品仍可以在欧盟市场上继续销售,此后没完成MDR认证的企业需撤回产品,不得继续销售,直至其重新获得新认证。
但由于受特殊时期、以及指定认证机构数量限制,很多出海欧洲的医疗器械企业即便及时响应,仍面临炮队至今却未能获得MDR认证的问题。为避免市场混乱,欧盟委员会相应给出了过渡期延长的办法。
MDR法规将医疗器械划分为I、IIa、IIb、III四个风险分类,过渡期延长也以此为依据。风险分类划分详见:
【延长后的MDR认证时间】
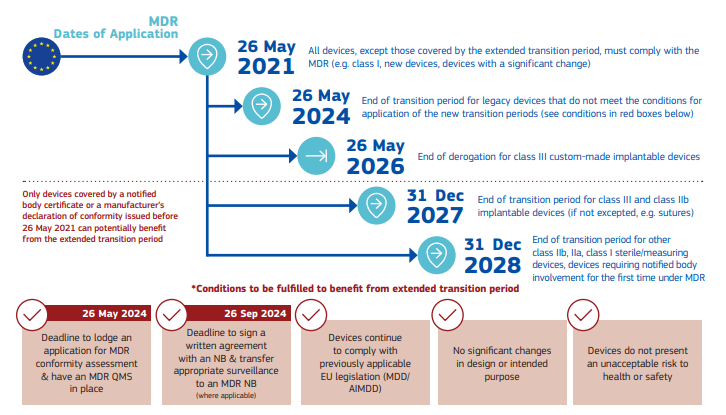
*信息来源:European Commission

当然想借助过渡期顺利完成MDR认证的医疗器械也必须满足一些条件。企业须在2024 年 5 月 26 日前向认证机构提出申请,并在同年 9 月 26 日前与认证机构签署协议;或按 MDR Article 59(1) 或 Article 97(1)要求,拿到主管当局的减免/豁免权。
此外,MDR Article 120.4规定的销售(sell-off)条款已废除,允许获得指令证书并投放市场的医疗器械继续出售,不设截止日期。
由此可见,即便是产品已在欧盟市场流通的医疗器械企业,面对法规的更新与不断补充更新,想要顺利进行新一轮的认证确保其医疗器械符合新规要求也绝非易事。
针对MDR新规带来的市场变化,美最时医疗子公司Altride Healthcare、德国LS医疗公司和泽理氪医学科技(北京)有限公司,将于本月底共同举办网络研讨会,欢迎报名参加,向专家学习如何应对进入欧盟医疗器械市场的复杂性:

参会注册链接:Navigating Chinese Medical Device Companies to the EU Market
Altride Healthcare、德国LS医疗团队及本土医疗科技企业泽理氪合作,旨在依据出海欧洲的中国医疗器械公司实际需求,凭借自身对欧盟市场及法规熟识的优势,提供模块化、定制化的服务与帮助。
点击下载宣传页,了解我们的服务和优势:LSmedcap-Altride-Flyer.pdf
如需要进一步对服务或本次网络研讨会咨询有任何疑问,欢迎联系:
岳丽娜 客户经理
serina.yue@altridehc.com
158 1114 8019

【关于Altride Healthcare】
Altride是一家专注于医疗业务的香港公司,隶属于美最时集团。美最时于1806年在德国成立,拥有200多年的丰富经验(其中包括超过155年的亚洲贸易)以及结构灵活的全球网络,50多家子公司遍及德国和全球各地。
Altride为医疗技术、医疗耗材、药品包装、制药机械和生命科学领域的客户提供全面而专业的定制服务,助力其业务迈向新的高度。
联系方式:
网址www.altridehc.com
邮箱info@altridehc.com
电话+862-2548 2048
医疗器械、新材料、人工智能;
一定技术壁垒



