
药物传送系统研究的目标是通过研制新的临床药物制剂,帮助病人降低药物副作用,提高药物使用效率。
目前可控药物传送系统主要包括缓释控给药系统和靶向药物传送系统,本文主要介绍靶向给药系统。
靶向药物传送系统一般是指经由血管注射等给药,利用纳米药物载体(脂质体、纳米粒子、细菌、生物纳米机器人等)将药物传送到疾病所在的目标区域[1]。其优势(特点)主要表现为:PEGylation(使用聚乙二醇等修饰纳米粒子表面),改变药代动力学、EPReffect向主动靶向运输的改变、基于自主性药物载药的靶向药物递送。
1、靶向药物传送系统分类
靶向药物传送系统传统上可分为被动靶向传送和主动靶向传送。
(1)被动靶向运输(EPR effect增强渗透滞留效应)
被动靶向传送是指注射的药物粒子通过肿瘤、感染、炎症等有漏洞的脉管系统到达疾病组织的过程,也称作增强渗透滞留效应。由于通过增强渗透滞留效应,到达疾病组织的药物粒子通常只有很少一部分(<10%),大量的药物粒子(>90%)到达了其他器官—肝、脾、肺、肾等,因此,被动靶向药物传送很难称作一种选择性的靶向药物传送[2]。
(2)主动靶向运输
通过特定配体与受体的结合(如:配体-受体相互作用、抗体-抗原相互作用、凝结素-糖相互作用),使药物与靶向细胞相结合,通常被称为主动靶向药物传送[3]。然而配体与受体结合的基本前提是二者距离很近,通常需要小于0.5nm,因此很难实现。
(3)基于血液循环和渗透技术的系统主动靶向药物传送
基于血液循环和渗透技术的系统主动靶向药物传送包括:通过药物或药物载体上特定配体与靶向病变细胞上受体相结合而进行的药物传送和局部位置药物载体通过特定方式激活而释放药物分子的传送方法。
a、 如图1为通过药物或药物载体上特定配体与靶向病变细胞上受体相结合而进行的药物传送的过程,血液循环的渗透致使药物积累到目标区域(如肿瘤区域),即EPR效应。由于药物载体需要经过漫长的血液循环后才能到达目标区域,因而这种药物传送方式的前半阶段实际上是一种被动的药物传送,后半阶段药物到达特定位置附近进行配体和受体的结合,因此是主动靶向的作用。
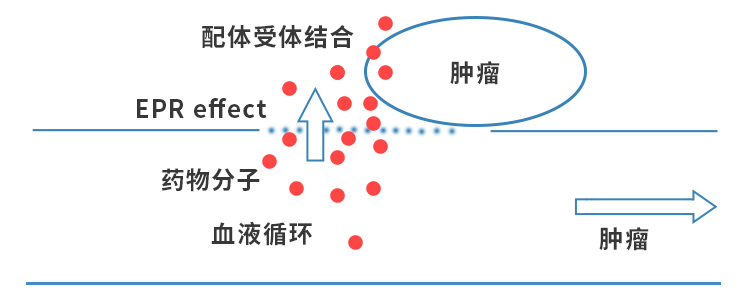
图1 主动靶向药物传送过程
由于很多药物或药物载体在人体循环系统中的保持时间有限,很多药物在没有到达目标区域就已经被分解进而被人体其他组织器官所吸收,这会给人体健康组织带来副作用。
为了延长药物或药物载体在人体血液循环系统中的保持时间,增强渗透滞留效应,通常会将药物或药物载体表面进行涂装(PEGylation)以改变药物代谢动力学特性。
然而,这虽然增加了药物载体在体内的保持时间,但并不能使药物在血液循环过程中只聚集到病变目标区域,相反,其中很大比例的药物将会积累在其他器官。
b 、局部激活药物释放的药物传送是指当药物载体到达体内目标区域后,可以实现自动激活药物载体释放药物,或者由体外信号激活载体释放药物。自动激活信号可以是体内目标位置处的特种酶或PH值的变化等;体外激活信号包括光、温度、磁场以及超声波等[4]。
(1)PEGylation
PEGylation通过改变纳米药物粒子药代动力学,延长纳米药物粒子在血液循环系统中的滞留时间,从而提高纳米粒子到达肿瘤等疾病目标的比例[5]。虽然聚乙二醇修饰过的纳米药物粒子可以延长其在血液循环系统中的滞留时间,但药物粒子到达肿瘤等疾病目标的量仍然十分有限。
(2)从EPR effect到主动药物靶向传送
在 EPR effect 的基础上,通过在纳米药物载体表面修饰特异性配体(比如抗体、多肽),利用配体与肿瘤细胞或肿瘤血管过度表达的受体相结合可以提高纳米药物到达靶向目标部位的比例,同时通过外部磁场力引导药物载体至肿瘤组织后,触发纳米药物载体释放药物。
(3)基于自主性药物载体的靶向药物传送
纳米机器人是一种可供选择的自主性药物载体,由于其体积小、能够在纳米范围内操作,因此特别适用于人体循环系统的药物传送以及各种疾病的诊断。自主微纳米机器人可通过血液和淋巴系统渗透进入更深层的组织[6],在提高靶向药物传送精度方面具有很大的潜力。目前纳米机器人按来源可分为生物医学系统和人工制造两大类。
a 生物医学系统的一个典型代表—细菌,细菌的大小从200nm到1μm,它能够主动渗透进入病变组织等部位,这对于药物传送是非常有吸引力的。有几种细菌对于肿瘤部位具有很好的倾向性,如沙氏门菌、双歧杆菌、埃希氏杆菌和梭菌,双歧杆菌和梭菌属于专性厌氧菌,可以聚集在含氧低的肿瘤部位,而兼性厌氧菌,如沙氏门菌和埃希氏杆菌则在含氧低或富氧的肿瘤环境都可以聚集,它们可以通过趋化性(肿瘤分泌的化学物质标记物)到达目标肿瘤部位,也可以通过 EPR effect聚集到肿瘤部位。
b 人工制造自主性药物载体的典型代表—纳米机器人,主要包括通过微电子、纳米电子技术制造的纳米机器人,以及生物混合方法组装的纳米机器人。纳米机器人是一种根据分子生物学原理人工制造的、尺度级别在 10−9m、能够在人体内自由扩散并可以与特定细胞进行分子级交互的分子机器。
由于纳米机器人可以通过人体血管网到达目标位置,所以可用于将药物直接传送到目标区域而尽量不给健康组织带来副作用,进而可以取代传统静脉注射给药的方式。
纳米药物是用纳米生物技术将药物等生物活性分子与载体材料相复合,进而利用纳米效应改变所载活性成分药代动力学、药效及药理学等方面的性质而获得显著临床优势的纳米组装体。所携带的成分可以是烷化剂、抗代谢类药物等小分子化合物,也可以是多肽、蛋白质、核酸药物等大分子或造影剂。
以抗肿瘤药物为例详细说明普通药物在运输过程中的难点问题以及纳米药物所具有的优势[7]:
通常静脉注射后的药物在体内需经历复杂的五个步骤才能进入实体瘤的肿瘤细胞内释放药物,包括在血液系统中循环(circulation,C)、向肿瘤部位内蓄积(accumulation,A)、在肿瘤组织内渗透扩散(penetration,P)、被肿瘤细胞内化(internalization,I)以及在细胞内释放药物(drug release,R),即CAPIR cascade级联输送过程(如图2)[8]。
这一过程中需要面临:
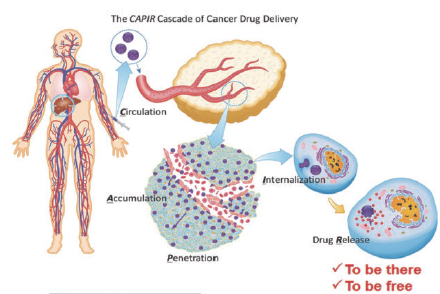
图2 肿瘤纳米药物将药物输送至肿瘤细胞内的CAPIR级联输送过程
纳米药物在稳定性、表面性质及尺寸等方面具有优势,如通过调控纳米药物稳定性使其在血液循环系统中稳定的负载药物而在细胞内变得不稳定释放药物;通过调控纳米药物表面性能使其PEG化、电中性等达到“隐身”的效果而在肿瘤细胞附近脱去聚乙二醇(PEG)、带上正电荷等方法获得黏附细胞能力;通过调控纳米药物的尺寸增强肿瘤内的渗透能力(如图3)[10]。这些机制可以改善纳米药的理化性质、提高成药性,同时还可利用肿瘤部位血管的高通透性和淋巴回流缺失性实现在肿瘤组织的蓄积效应,减少在正常组织中的分布从而降低毒副作用[11]。
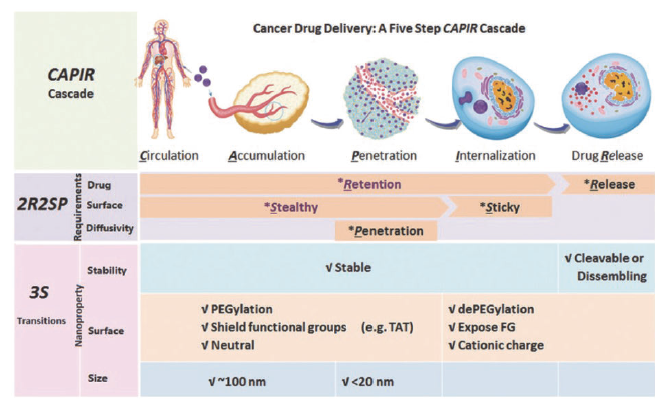
图3 CAPIR级联输送过程中纳米药物的要求及其稳定性、表面性质及尺寸的相互转化[12]
因此与普通药物制剂相比,纳米药物具有基于纳米结构的尺度效应,有以下优势:
⑴ 纳米药物可以通过改变药物分子的物理化学性质(水溶性、脂溶性等)改善其药代动力学,帮助药物分子跨越生理和病理屏障,从而提高生物利用度[13];
⑵ 纳米药物可实现主动、被动靶向,增加纳米药物在病灶内的局部浓度,提高药效的同时减少副反应的发生以达到更为安全有效的疾病诊治目的[14];
⑶ 基于新型成像技术同步可视化肿瘤治疗效应,如QD(量子点,详见《纳米药物1》);
⑷ 延长药物循环时间,控制药物释放,提高病人的依从性;
⑸ 通过精巧“伪装”降低生物体内的免疫识别和网状内皮系统的清除作用,保护活性分子免受酶解,增加药物体内滞留时间、延长药物半衰期、增强药效[15];
⑹实现多样性和智能性。除生物活性的化学分子外,纳米载体也可包载多肽、核酸等生物活性物质,以及临床治疗外的造影剂等。
参考资料:
[1] Torchilin V P. Drug targeting[J]. European Journal of Pharmaceutical Sciences, 2000, 11: S81-S91.
[2] Taurin S, Nehoff H, Greish K. Anticancer nanomedicine and tumor vascular permeability; Where is the missing link?[J]. Journal of Controlled Release Official Journal of the Controlled Release Society, 2012, 164(3): 265-275.
[3] Canal F, Vicent M, Pasut G, et al. Relevance of folic acid/polymer ratio in targeted PEG-epirubicin conjugates[J]. Journal of Controlled Release, 2010, 146(3): 388-399.
[4] Lin C Y, Liu T M, Chen C Y, et al. Quantitative and qualitative investigation into the impact of focused ultrasound with microbubbles on the triggered release of nanoparticles from vasculature in mouse tumors[J]. Journal of Controlled Release Official Journal of the Controlled Release Society, 2010, 146(3): 291-298.
[5] Harris J M, Martin N E, Modi M. Pegylation: a novel process for modifying pharmacokinetics[J]. Clinical Pharmacokinetics, 2001, 40(7): 539-551.
[6] Wang W, Castro L A, Hoyos M, et al. Autonomous Motion of Metallic Microrods Propelled by Ultrasound[J]. Acs Nano, 2012, 6(7): 6122-6132.
[7] Wang, Y Li, Nie G . Multifunctional biomolecule nanostructures for cancer therapy[J]. Nature Reviews Materials, 2021
[8] Sun Q, Sun X, Ma X, Zhou Z, Jin E, Zhang B, Shen Y, Van Kirk EA, Murdoch WJ, Lott JR, Lodge TP, Radosz M, Zhao Y. Adv Mater, 2014, 26:7615–7621
[9] Miao L, Newby JM, Lin CM, Zhang L, Xu F, Kim WY, Forest MG, Lai SK, Milowsky MI, Wobker SE,
Huang L. ACS Nano, 2016, 10: 9243–9258
[10] 刘静,唐浩,米鹏,魏于全.抗肿瘤纳米药物临床转化研究进展[J].科技导报,2018,36(22):118-126.
[11] Maeda H, Wu J, Sawa T, Matsumura Y, Hori K. J Control Release, 2000, 65: 271–284
[12] Sun Q, Radosz M, Shen Y. J Control Release, 2012, 164: 156–169
[13]Shi J, Kantoff P W, Wooster R, et al. Cancer nanomedicine: Progress, challenges and opportunities. Nat Rev Cancer, 2016, 17: 20–37
[14] Petros R A, DeSimone J M. Strategies in the design of nanoparticles for therapeutic applications. Nat Rev Drug Discov, 2010, 9: 615–627
[15] Lu Y, Aimetti A A, Langer R, et al. Bioresponsive materials. Nat Rev Mater, 2016, 2: 16075–16091
文章来源:和义广业创新平台
医疗器械、新材料、人工智能;
一定技术壁垒



