
导 读
本篇共 3286 字,阅读时间预计 2-3 分钟
从细胞培养物,血液或分解的组织中获得细胞悬浮液,将该细胞悬浮液分成数个试管进行染色,保留未染色细胞作为对照。通过添加标记有荧光探针的抗体或染色细胞成分的染料对其他细胞样品染色,如:分析细胞内蛋白质时,首先必须将细胞固定(使用福尔马林缓冲液)并进行透化(使用透化剂),以使抗体和染料进入细胞。
免疫细胞通常需要接受特定的刺激才能活化,活化的细胞会表达高水平的转录因子、细胞因子、趋化因子以及其他可通过流式细胞检测的调节因子,通过对激活因子的选择来确定抗体(流式抗体涵盖:CD标记物、转录因子、细胞因子、趋化因子和生长因子、信号通路标记物,如磷酸化蛋白)。
细胞与抗体或染料孵育后,将细胞在缓冲液中洗涤,然后重悬在基于盐的缓冲液中。
典型的实验从单细胞悬浮液中的荧光标记细胞开始,可以使用任何颗粒类型的样品。将样品置于流式细胞仪上,样品被吸到仪器中,细胞悬浮在一种被称为鞘液的生理缓冲液,流体系统(管道、泵和阀)将初始样品悬浮液排列成单列细胞流,并使细胞通过流式细胞仪以进行分析。
细胞与激光发生相互作用的地方称为激光检测点(激光拦截)(图),这是荧光检测发生的地方。当激光束照射到单个细胞时,一些光会撞到细胞内的物理结构,导致光线散射。这种光散射可被测量,并且与相对细胞大小和细胞内的结构相关。这些测量称为前向角散射(FSC)和侧角散射(SSC),FSC和SSC取决于收集光的位置相对于激光路径的角度。几乎同时,来自激光器的光激发与细胞相关的所有荧光团,产生荧光发射。所有这些光被检测器收集并通过流式细胞仪的电子元件进行处理。通过激光检测点之后,流体系统会将不需要的细胞输送到废液桶中。在细胞分选仪中,细胞将在激光检测点被分选和输送到收集管中,以供后续实验使用。
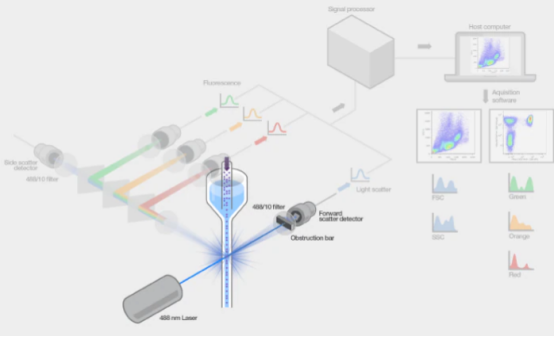
图 激光监测点
5、分析数据
通过收集的流式细胞仪数据创建直方图和点图以进行分析。
下图为单参数直方图,X轴表示荧光信号或散射光信号相对强度的值,Y轴表示细胞数,通过直方图可直观单个参数的细胞数量。
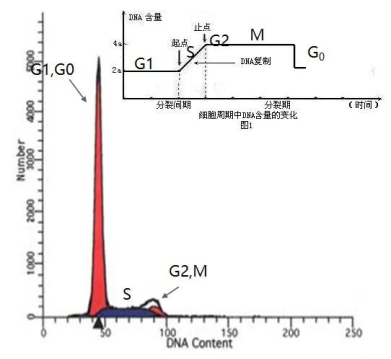
图 单参数直方图
下图为双参数二维点图,其中X坐标表示该细胞一参数的相对含量,Y坐标表示该细胞另一参数的含量,通过获得的数据可以很容易把全血样本中淋巴细胞、单核细胞及中性粒细胞区分开,从而可以分别分析各细胞亚群的统计数据。
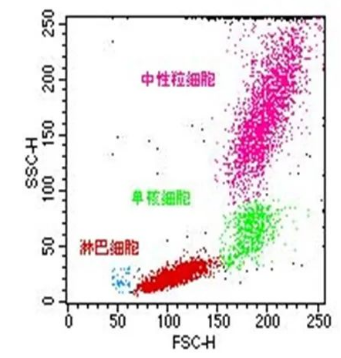
图 双参数直方图
(二)分类
流式细胞仪除了上面介绍的的传统的细胞仪之外还有一些其他类别的细胞仪,如细胞分选仪、质谱流式细胞仪、成像细胞仪等,下面我们就其他类别的进行简单介绍。
质谱流式细胞仪结合了飞行时间质谱仪和流式细胞仪,其技术原理是采用金属同位素标记特异性抗体来标记细胞表面和内部的信号分子(蛋白),将标记好的细胞通过流式被分离成单个细胞依次进入电感耦合等离子体质谱,单细胞首先被等离子体炬离子化为一个独立的离子云,随后离子云中的各种标签金属离子被质谱精确检测出来,得到单细胞的质谱数据,最后数据被转换为标准的流式数据,通过生信分析团队进行多维度的数据分析,实现对细胞表型和信号网络的精细表征以及价值信息的有效挖掘(如图所示)2。
流式质谱相比于传统的流式有诸多优势,如通量较大,>40个项目,目前最多可拓展到130余项,拓展性好;细胞内不含荧光,没有背景噪音,稳定性高,CV≤3%;ICP质谱灵敏度高,金属离子彼此间没有信号干扰,不需要补偿。但是同时也有检测速度相对较慢(1000 个细胞/秒)和不可回收细胞用于后续检测的不足。
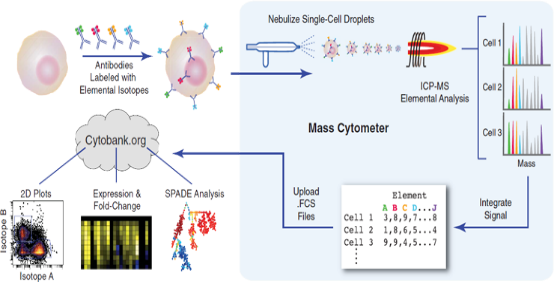
图 质谱流式的技术原理
2、成像细胞仪
成像流式细胞仪是将传统流式细胞术与荧光显微镜相结合,它允许在单个细胞和群体水平上快速分析样品的形态和多参数荧光3,可以跟共聚焦显微镜或荧光显微镜一样跟踪单个细胞内的蛋白质分布,也可以像流式细胞仪一样处理大量细胞,在多种应用场景如细胞信号传导、共定位、DNA损伤和修复中发挥作用。
细胞分选仪是一种特定类型的传统流式细胞仪,它可以纯化和收集样品以供进一步分析,其技术原理细胞分选机通过高频振荡液体样本流以产生液滴来分离细胞,然后液滴被赋予正电荷或负电荷并通过金属偏转板,在那里它们根据其电荷被引导到特定的收集容器。收集容器可以是离心管、载玻片或96孔板/384孔板。常见的细胞分选仪有石英比色皿和“空气激发/喷射”两种类型的,它们的不同之处在于激光检测点的位置,石英比色皿细胞分选仪具有固定的激光对准,更容易为分选做好准备,“空气激发/喷射”细胞分选仪需要每天校准激光,设置起来更困难,但更适合小颗粒检测。
-免疫分型:是流式细胞术较常见的应用,其利用荧光偶联抗体与细胞表面对应的抗原特异性结合,之后利用流式细胞仪根据细胞表面的荧光对细胞做出分析。
-抗原特异性反应:使用特定抗原刺激细胞,通过MHC多聚体对特定的抗原的结合,之后与识别该抗原的T细胞结合,用来表明T细胞对特定抗原的反应水平,从而寻找细胞因子产生、细胞增殖、细胞激活、细胞记忆或抗原识别等。
-胞内因子检测:通过蛋白转运抑制剂处理使细胞产生的各种细胞因子在胞内积累,后对细胞进行活力标记和细胞表面标记染色并检测。
-细胞增殖检测:通过靶向与细胞增殖相关的事件来检测,如将胸苷类似物 (BrdU) 掺入复制中的DNA、增殖相关抗原(Ki67、PCNA)的表达检测等。
-细胞凋亡检测:通过与凋亡相关的级联事件的靶点进行细胞凋亡检测。
-荧光蛋白检测:荧光蛋白常被用作蛋白质表达的标记,即细胞被转染含有启动子序列、目的基因序列和荧光蛋白序列的质粒。当目的基因表达产生目的蛋白时,其下游的荧光蛋白基因共同表达,从而使细胞发出荧光信号。该技术可应用于体内追踪移植细胞,检测细菌或病毒感染,以及鉴定基因功能等。
-细胞周期检测:通过使用饱和量的DNA结合染料对DNA进行染色,个别染料可以进入活细胞,在不伤害细胞的情况下染色DNA,比如Hoescht 33342。在细胞周期检测中,以低流速线性放大的方式采集样本,然后使用倍性建模软件进行分析,以确定细胞周期阶段。
-RNA检测:RNA流式细胞术将传统流式细胞术和荧光原位杂交(FISH)结合应用,检测RNA表达和蛋白表达,当无法检测目标蛋白表达,但可以检测RNA表达时,流式细胞仪仍可以发挥作用。
-细胞分选:利用流式细胞分选仪来分离纯化细胞或颗粒以供进一步分析。一般来讲,任何具有荧光的细胞或颗粒都可以被分选,细胞可以被分选到96孔板、384孔板、管中和载玻片上。常见的样本有表达荧光蛋白的转染细胞、干细胞、肿瘤浸润淋巴细胞、肿瘤细胞和白细胞群。
绝对细胞计数:可用于任何免疫分型研究,该技术利用随样本一起采集的已知浓度的荧光珠对样本进行分析,并将目的细胞群的数量与在同一样本中获得的荧光珠数量进行比较,以计算生成单位体积内的细胞数量。
小颗粒检测和分选:使用高灵敏度的流式细胞仪可以检测和分选外泌体和其他亚微米颗粒。
定量流式细胞分析:用流式细胞仪对细胞或微粒上标记的荧光分子进行定量分析,从而对细胞的生物分子进行精确测量,如每个分子表达的平均分子数、抗原数等。定量流式细胞分析不同于以往的相对荧光强度或阳性细胞百分率测量,它的检测更为准确、灵敏,如在获得性免疫缺陷综合症和“非典”的研究与治疗中,对外周血中的CD4+T淋巴细胞进行绝对记数来反映病情进展及监测疗效。
磁珠阵列测定:磁珠阵列测定是涂有针对特定可溶性蛋白质或核酸抗体的磁珠组,每个磁珠都有已知数量的荧光和特定的靶标,该靶标为磁珠在基质中的位置。将100多个珠子的集合与目标样品一起孵育,用荧光报告器处理,然后在流式细胞仪上用至少2个激光器获取以检测2种不同的荧光染料,特殊软件根据荧光计算分析物量。
吞噬作用测定:使用荧光标记的生物颗粒或细菌,可以使用流式细胞术检测吞噬作用。
排版:大大怪
医疗器械、新材料、人工智能;
一定技术壁垒



