和义广业【行业分析】之脑电极,本篇主要介绍有创脑电电极之表面贴附式电极以及其他新型脑电极。
本篇共 3497 字,阅读时间预计 3-4 分钟
(二)表面贴附式
表面贴附式按照其制作工艺与产品最终形态可分为两类,一类是基于传统的制造工艺制作的“大面积的”低通道数的贴附式网格电极,另一类是基于MEMS工艺与微纳加工制作的“小面积”高通道数的矩阵式电极;其中“大面积”低通道的电极在国内外具有相关产品获批,但是“小面积”的电极尚未见成功获批的产品。
1. 传统贴附式电极
传统贴附式电极主要是基于硅树脂等材料衬底,在衬底上按照矩阵排列了一些大面积的铂铱/不锈钢电极触点,触点大小一般在毫米级,而且电极阵列整体的厚度较厚(0.08-1mm),与脑皮层的贴附性并不是很好;虽然电极片的面积较大,可达138cm2,但是由于电极触点面积较大,这也进一步限制了电极片上所能放置的触点数量,导致电极的通道数受限,最高可达256通道;传统的贴附式电极产品实物图如下所示:
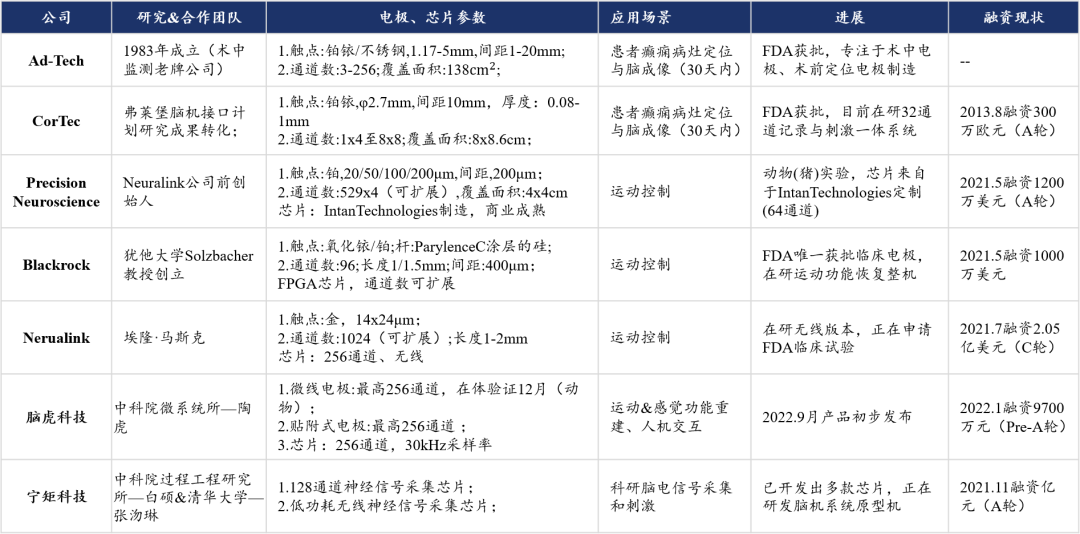
代表公司——Ad-tech
Ad-Tech公司1983年成立,在传统贴附式电极市场上属于老牌公司,与另一家做贴附式电极的公司——Cor-Tec占据较大份额;其公司主要产品为脑深部电极与贴附式电极。
传统式贴附式电极由于在临床上使用需要开颅,创伤较大,在国外已无太多临床应用,国内也是从2014年之后,此类传统的贴附式电极迅速减少;因此,目前在研究基于MEMS工艺制造的新型贴附式电极,其面积更小,厚度更薄(与脑皮层的贴附性更好),通道数更高。下文介绍部分新型贴附式电极。
2.1 Neurogrid
Neurogrid是以聚对二甲苯为绝缘层的4μm厚薄膜金属铂与金的电极阵列,触点大小为10x10μm2,间距为30μm,与神经元胞体的平均大小和神经元密度相匹配。电极触点处的界面材料采用了PEDOT:PSS,电导率和离子迁移率高;采样频率为20kHz,分辨率为16位,0.1-7500Hz信号的输入噪声为3-8μV。
大鼠试验证明其至少可以检测到皮层表面一下200μm处的神经元信号,
除了在大鼠身上进行记录之外,Neurogrid也在临床上对两个接受癫痫手术的病人进行了术中记录(8分钟&20分钟),相比于动物大鼠的记录时长还很短,但是这证明了Neurogrid在人体应用的可能性2。
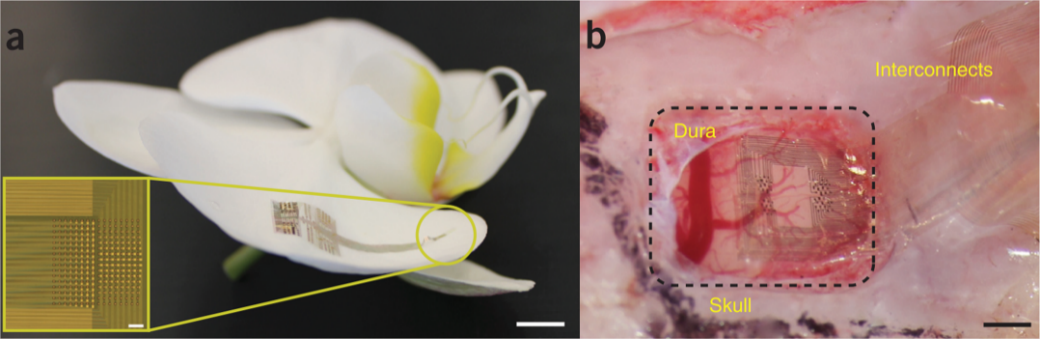
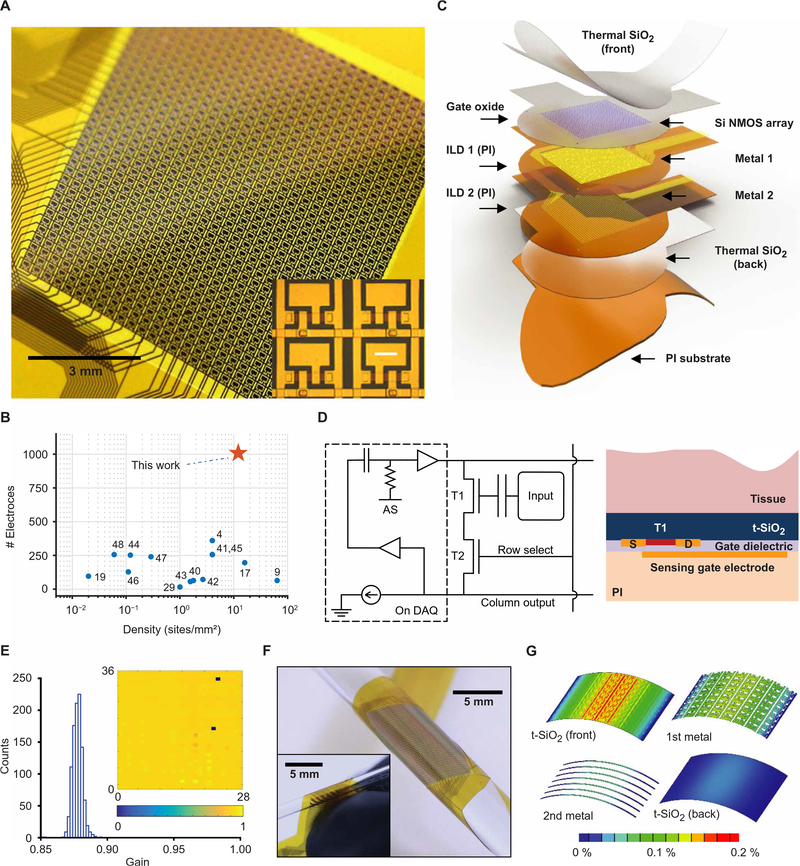
2.2 NerualMatrix
Neural Matrix专注于表面微皮质(μECoG),整体厚度约30μm,共28x36个通道,其电极是通过两层金属互连和嵌入多路复用电路(28列,36行),使用的是热生长的二氧化硅(t-SiO2)作为触点与大脑皮质之间的电容耦合界面介质,厚度约1μm。
对于表面贴附式电极来说,柔韧性和抗机械疲劳性能是系统的关键。Neural Matrix阵列在感应区只有29μm厚。在弯曲过程中每层产生最小的诱导应变。有限元分析(FEA)表明,当弯曲半径为2.5 mm时,在Si、t-SiO2和金属层中诱导的最大应变小于0.2%,低于断裂极限(~1%)。将器件重复机械循环至最小弯曲半径2.5 mm,循环次数达10,000次,未发现成品率变化或泄漏电流增加3。
图 Neural Matrix电极结构与测试结果图
2.3 铂纳米棒网格——PtNRGrids
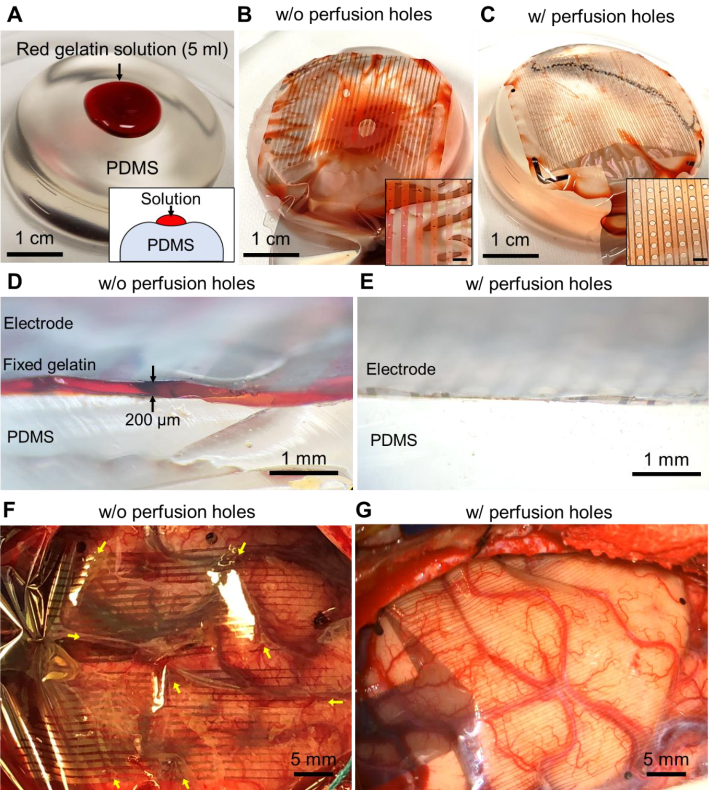
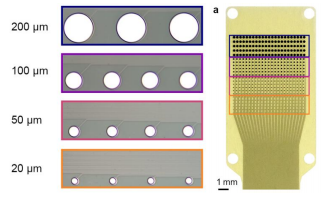
PtNRGrids以6.6μm厚的共形二甲苯C柔性薄片作为衬底,铂纳米棒(PtNRs)作为电极触点材料,制作工艺采用MEMS技术,触点宽度30μm,嵌入衬底内2μm;1kHz的输入阻抗为10±2kΩ(931通道的100μm的PEDOT:PSS触点在1kHz时的平均输入阻抗为15kΩ);1024通道同时进行采集,采样频率为20kHz;电极的机械稳定性符合《ANSI/AAMICI86:2019建议》标准规定。
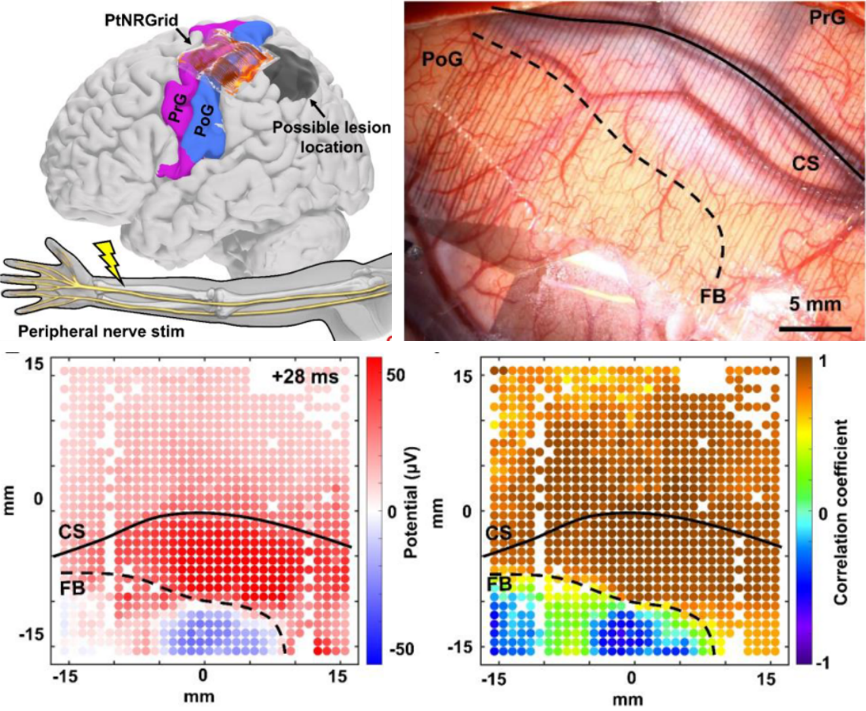
在衬底上做了穿孔,以避免脑脊液与触点接触产生电化学分流,如图所示, 图A表示在PDMS组织模型上放置接近人体温度的红色明胶液滴。PDMS模型的顶面有凹陷。将无穿孔(B)与有穿孔(C)的PtNRGrids分别放置在红色明胶滴/PDMS块的顶部,并同样用纱布轻轻按压。右下放大的插图显示了用1毫米刻度尺的照片。(D)和(E)分别为对应无和有穿孔的PtNRGrids和PDMS组织模型之间的横断面。(F)和(G)为无和有实际使用的PtNRGrids的图。脑脊液的位置用黄色箭头标出。
PtNRGrids根据触点间距、覆盖面积大小、通道数分为啮齿类动物用与人体用两个版本。其中触点间距为150μm、覆盖面积5x5mm2、1024通道的电极阵列为啮齿类动物用版本;触点间距为1.8mm、覆盖面积8x8cm2、2048通道为人体脑部用。
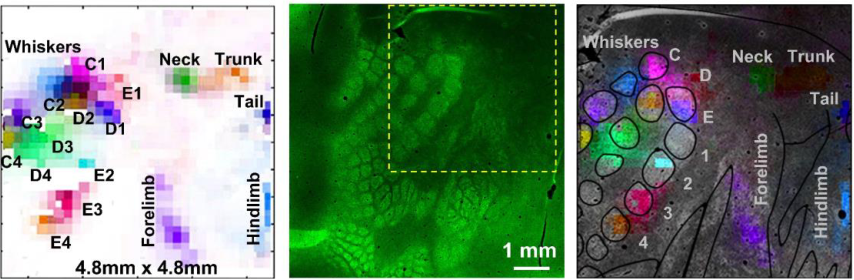
通过对麻醉小鼠刺激诱发脑电信号的动物实验(与传统的记录诱发反应技术对比)表明,PtNRGrids电极可以实时、准确、高分辨率的检测到诱发信号。(左)PtNRGrid记录的高伽马活动的空间地图——HGA,不同颜色的标签标明了被刺激的位置。(中)VGLUT2组织化学染色,电极植入位置用黄色虚线框标记。(右)HGA叠加在组织学(VGLUT2染色)图像上。
在动物实验的基础上,进一步在人体上进行了测试(4例脑肿瘤切除患者),术中监测外周神经刺激信号,以分辨脑肿瘤与正常脑区的边界,与传统的ECoG脑电图与fMRI进行对比,肿瘤边界曲线分辨准确度优于对比技术方式。(左上)重建的患者大脑和电极植入位置模型:手部附近植入电极,电刺激周围神经;fMRI图像显示了可能的病变位置。CS(central sulcus)代表中央沟和FB(functional boundary)代表躯体运动与感觉的功能边界。(右上)电极植入实图。(左下)刺激后28ms的刺激波的1024个通道的电位标测。(右下)相对于相对于网格中心的通道测量的波形的相关系数映射。
代表公司——Precision Neuroscience
Precision Neuroscience公司成立于2019年,由毕业于哈佛医学院的Neuralink公司创始团队八人之一的本杰明·拉伯波特创立,本杰明担任CTO;Precision Neuroscience的电极基于微纳工艺制造,触点采用铂金属,触点间距200μm,大小为20/50/100/200μm;通道数:529*4(2116通道),电极大小4x4cm;进度:目前已完成动物实验植入与信号采集,尚未进行后续的信号处理与分析(2022.2.2发布)。其电极形态如下图:
图 Precision Neuroscience电极示意图
硅是一种适用于集成电路器件刻蚀的生物兼容材料,也是制造密歇根型和犹他型电极阵列的基本材料。硅基微电极阵列具有微米级精度、高重复性、低成本、易加工等优点,是神经生理学研究的主要电极。
随着电极尺寸的设计逐渐减小,由生物相容的贵金属(铂、铱、金等)制成的电极接触。暴露出高阻抗但低电荷注入能力的问题。这严重限制了电极阵列空间分辨率的进一步提高。
与刚性电极材料相比,软导电性聚合物材料在脑组织的应变和炎症反应方面表现出更好的性能。例如,导电聚(3,4-乙二氧基噻吩基)(PEDOT)掺杂聚苯乙烯磺酸(PSS),具有良好的生物相容性、良好的导电性和易于合成等优点。导电聚合物还可以作为机械失配的缓冲,以减少大脑的异物反应。但PEDOT与金属电极之间存在附着力差的问题4。
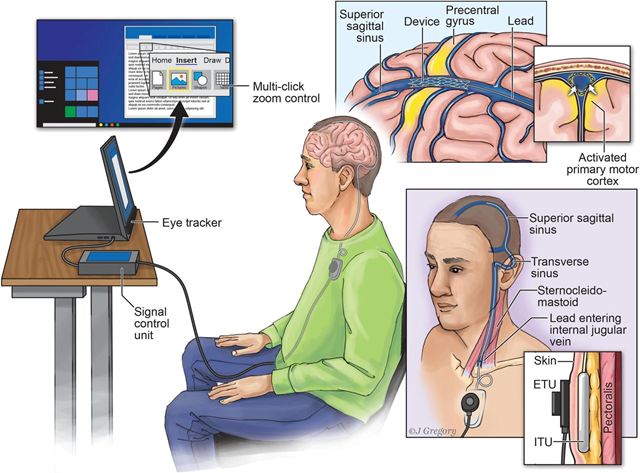
(一)支架型电极——Synchron
Synchron成立于2016年,创始人博士毕业于墨尔本大学临床神经科学专业,Synchron的电极设置在支架桥筋的交叉点上,通道数较少,仅16通道,但是其临床进展较快,目前已获得FDA批准,在美国完成一例临床入组手术;支架类脑电极的技术优势在于其植入无需进行开颅,采用微创介入的方式将电极放置进入颅内,降低了手术难度与风险。
其缺点在于:
①信号质量较差,约等同于硬膜上ECoG;
②受支架的限制,通道数不可能太高;
③后期患者需要持续的服用抗血栓药物,防止出现脑卒中。
另外从目前披露的报道来看,该技术路线仅能实现一些较为简单的控制电视、发推特等操作。
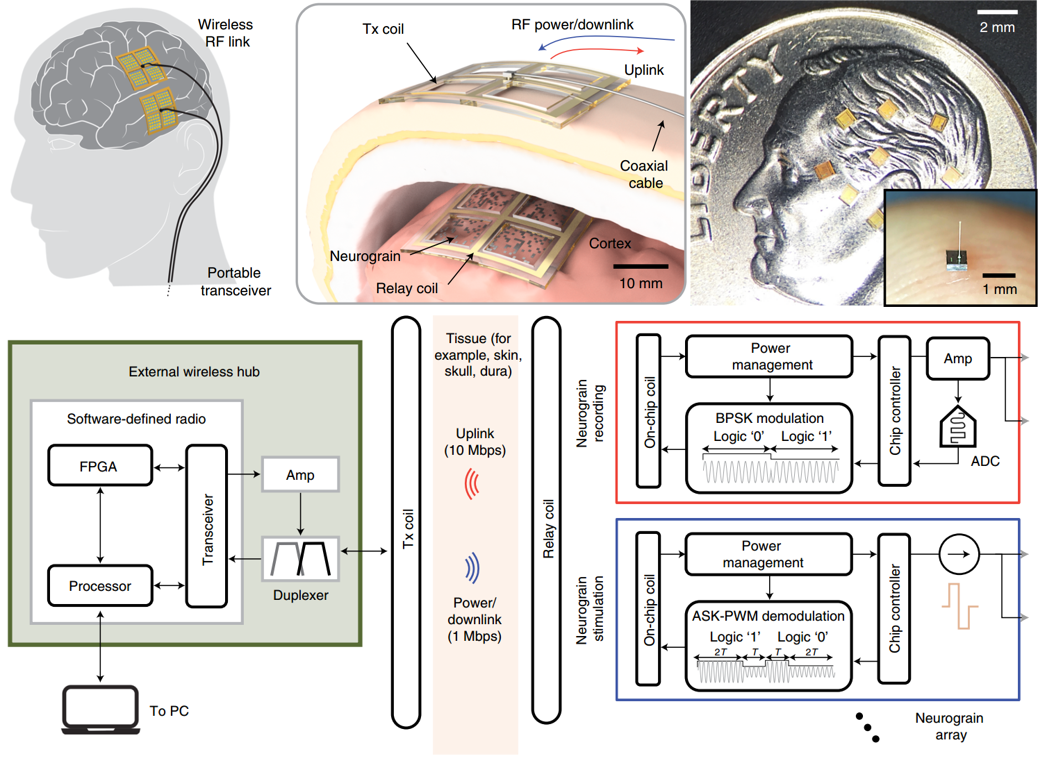
(二)分布式电极——Neurograin(神经粒)
Neurograin主要用于记录皮层ECoG信号,由数个小芯片组成,每个芯片体积约0.1mm3,下图展示了外部集线器与Neurograin群之间用于通信与近场能量传输的电磁接口、Neurograin的实物图以及整个系统的框图。
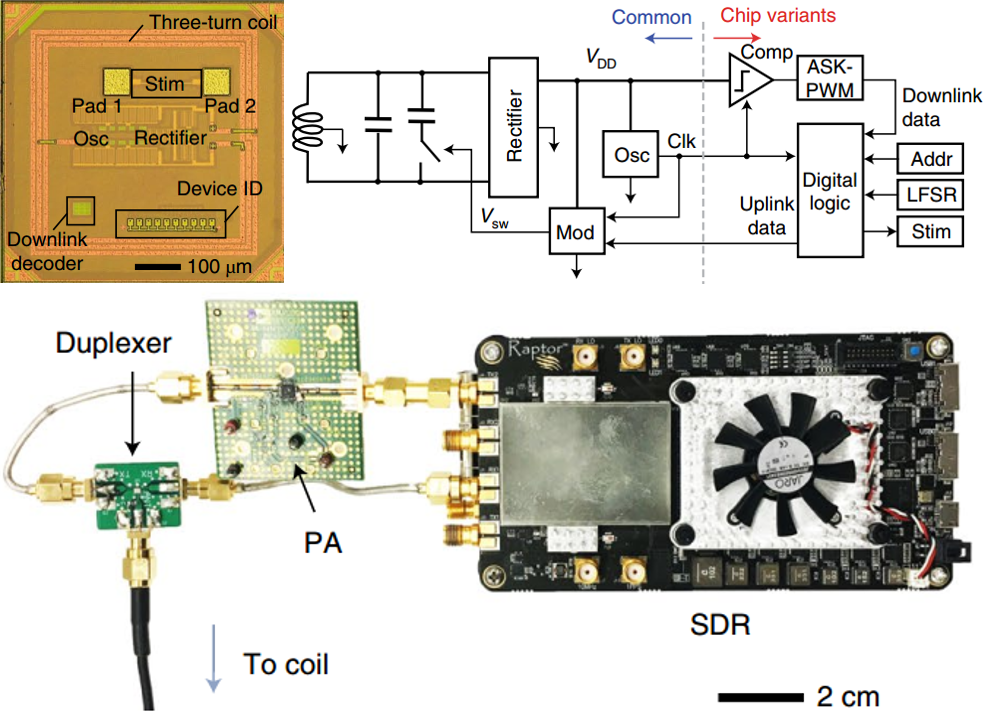
Neurograin是采用COMS工艺制造的微芯片集群,每个微芯片都有相应的信号采集与输出电路,下图显示了芯片的显微照片、电路原理图、外部射频通信集线器;芯片大小为500μmx500μm,上面包括一个三圈微线圈、整流器、下行解码器和设备ID以及与神经组织的生理界面的一对接触电极触点(电极触点材料为金,60μm)。设备ID用于Neurograin在通信网络集群中的寻址功能实现,电极触点用于记录神经信号以及发出脉冲刺激相应神经组织。电路原理图中左侧蓝色指向通信电路,右侧红色箭头指向记录与刺激电路,为低功耗与小型化的电路。(右)外部射频集线器,与微芯片之间的距离为8mm。
信号记录电路使用直流耦合的电压-电流转换器与模数转换器通过电极触点(不需要笨重的交流耦合电容器)直接检测神经电位来采集ECoG信号,输入参考噪声为2.2μV,带宽为500Hz,ADC参数为1μ采样率和8位分辨率。
微电流刺激电路设计为可提供具有可编程脉冲宽度(100、200和400μs)的两相电流脉冲,脉冲宽度由外部无线集线器通过下行链路确定。电流刺激的最大水平取决于芯片功率水平,范围在25μA以内。
系统的通道数取决于外部集线器与Neurograin微芯片之前的通信协议方式,目前该团队公开的数量可达425个,另外正在开展770(理论上可以)个微芯片的通信研究。Neurograin目前已进行过48个微芯片的啮齿类动物小鼠测试实验,且如果采用亚微米的CMOS工艺,则可以进一步减小微芯片的体积,以减少植入设备的侵入性。
[1] Zhang, B., Deng, C., Cai, C., & Li, X. (2022). In Vivo Neural Interfaces—From Small- to Large-Scale Recording. Frontiers in Nanotechnology, 4. https://doi.org/10.3389/fnano.2022.885411
[2] Khodagholy, D., Gelinas, J., Thesen, T. et al. NeuroGrid: recording action potentials from the surface of the brain. Nat Neurosci 18, 310–315 (2015). https://doi.org/10.1038/nn.3905
[3] Chiang CH, Won SM, Orsborn AL, Yu KJ, Trumpis M, Bent B, Wang C, Xue Y, Min S, Woods V, Yu C, Kim BH, Kim SB, Huq R, Li J, Seo KJ, Vitale F, Richardson A, Fang H, Huang Y, Shepard K, Pesaran B, Rogers JA, Viventi J. Development of a neural interface for high-definition, long-term recording in rodents and nonhuman primates. Sci Transl Med. 2020 Apr 8;12(538):eaay4682. doi: 10.1126/scitranslmed.aay4682. PMID: 32269166; PMCID: PMC7478122.
[4] Zhang B, Deng C, Cai C, et al. In Vivo Neural Interfaces—From Small-to Large-Scale Recording[J]. Front. Nanotechnol. 4: 885411. doi: 10.3389/fnano, 2022.
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正,资料内容侵删。
排版:大大怪