
导 读
和义广业【行业分析】之生物人工肝,将针对肝衰竭的不同治疗手段,包括目前常用的非生物型人工肝和肝移植,以及未来具有治疗前景的生物型人工肝进行介绍。本篇带大家了解肝衰竭未来具有应用前景的治疗手段—生物型人工肝目前的技术难点。
本篇共 4998 字,阅读时间预计 3-4 分钟
生物型人工肝
基本原理:将患者血浆通过体外循环与生物反应器中的人肝细胞进行物质交换,短时间替代肝脏工作,并分泌促肝细胞生长活性物质,促进受损肝脏再生修复,性能上更接近人体肝细胞,具有解毒、合成、分泌和转化生物活性物质的功能(如图所示)。是今后人工肝发展的方向,但目前尚处于动物实验或临床试验阶段。

图 人工肝图示1
生物型人工肝从研发到入市面临着诸多的问题,在技术上面临/需要克服的问题主要有两大类:一是理想的细胞来源,二是适合细胞生存以及代谢的生物反应器;在入市上存在的问题涉及申报定性、上市路径探索、细胞培养的标准化及质量控制、细胞培养成本高、产品价格等,下面就技术上的这些问题进行详细的介绍。
理想的肝细胞源要求具有完整的肝功能、良好的增殖能力以及无致瘤、无感染的风险。肝细胞功能的好坏直接关系到生物人工肝的性能,目前常用的肝细胞源有原代人肝细胞、原代猪肝细胞、人肝癌细胞系HepG2、HepaRG、永生化细胞以及干细胞等2。
原代人肝细胞是最理想的细胞来源。MELS采用原代人肝细胞,已经取得了良好的临床治疗效果。然而用于分离原代肝细胞肝源稀缺且细胞的产量和活力都比较低,在体外增殖能力有限且容易丧失肝功能。
目前通过改善细胞培养基成分、增加细胞外基质、采用修饰生物材料、三维培养3以及肝细胞与非实质细胞共培养等方法维持肝细胞的表型并改善肝功能。在这些方法中肝细胞与非实质肝细胞的共培养对于保持原代人肝细胞的功能是非常重要的。共培养的非实质肝细胞包括人脐静脉内皮细胞、内皮血管结构、以及骨髓来源的间充质干细胞等。改良聚醚-聚氨酯膜的生物修饰支架可以增强原代人肝细胞的功能并维持较长的时间。这些结果表明改造过的生物支架是生物人工肝潜在的应用材料。
由于易获得性和高功能活性,原代猪肝细胞是最常用于生物人工肝的细胞之一。原代猪肝细胞的BAL的临床随机对照试验证明其在急性肝衰竭的患者中是安全和有效的4。Scott L.Nyberg等将猪肝细胞培养成肝细胞悬浮球用于生物人工肝,并延长了急性肝衰竭猪的生存期。然而,猪内源性逆转录病毒(PERV)具有猪传人异种动物性感染的潜在风险。目前没有证据表明其在人体内产生异种感染,长期免疫抑制患者在接受载有猪肝细胞的生物反应器治疗,8年的随访中没有发现PERV感染。然而,PERV可以转移到生物反应器的滤过膜,并且猪肝细胞上清液与人细胞可以短期直接接触,PERV仍具有感染人细胞的风险。由于跨物种的免疫反应和潜在的异种动物病毒的感染限制原代猪肝细胞在生物反应器中的应用,欧洲几个国家禁止使用原代猪肝细胞用于生物人工肝。
HepG2因其容易获得且分泌人蛋白质的特点最常用于生物人工肝。肝肿瘤衍生的细胞系C3A,HepG2的亚克隆,已经被ELAD系统用于临床试验。将C3A细胞应用为ELAD系统的细胞部分,在一系列的临床对照试验后,取得了一定的临床治疗效果,但是生存率没有明显改善。藻酸盐微囊培养C3A细胞能够有效地改善白蛋白合成,并且容易形成正常肝细胞特征的微绒毛状结构,从而提高治疗效果5。
HepaRG细胞系是人双能肝祖细胞系,在有或没有DMSO的条件下可以高密度分化成肝细胞簇,因此HepaRG细胞非常适合生物人工肝的应用。
为了解决原代肝细胞体外培养容易失去肝功能并不能长期增殖的问题,研究者们通过猿猴病毒40大抗原基因(SV40LT)或人端粒逆转录酶转导开发了永生化肝细胞。为了避免SV40LT致瘤的风险,研究人员使用酶特异性重组敲除可逆永生化人肝细胞中的靶向SV40LT基因,建立可逆永生化细胞系6。永生化人肝细胞与人星状细胞共培养,或用微囊化大规模培养,以改善永生化人肝细胞的分化等级和功能,这些细胞可以作为生物人工肝的选择。
hESCs从人受精胚胎囊胚的内细胞团中分离出来,具有强大的自我更新和多功能分化的潜能;hESCs具有产生功能性肝细胞的潜能,可以作为细胞替代疗法和肝细胞移植的肝细胞源。3D共培养系统中胶原支架和超纤维纳米纤维可以促进hESCs的肝细胞分化。结合组织工程的hESCs与3D共培养系统可以提供功能性肝细胞的来源,能够潜在用于新型生物人工肝。
iPSCs被定义为诱导多能干细胞,具有胚胎干细胞的特征,包括形态学、关键多能基因的表达、以及无限的自我更新能力。人类iPSCs通过四种转录因子的逆转录病毒诱导产生体细胞,有效诱导成功能性肝细胞样细胞。惠利健等将成纤维细胞诱导成具有肝功能的细胞,并应用到生物人工肝中,延长了急性肝衰竭猪的生存时间。
人类间充质干细胞包括骨髓间充质干细胞(hBMSCs)、人脂肪干细胞(hADSCs)等。骨髓是造血干细胞和间充质肝细胞的储存库,hBMSCs因其在体外相对容易获得和扩增,可以作为合适的治疗细胞。来自hBMSCs的肝细胞样细胞已经成为原代细胞的替物,可以有效地诱导成功能性肝细胞。hADSCs与BMSCs不仅具有相似的分化为肝细胞的潜能的特征,而且获得也比较容易。人脂肪组织来源的MSC在体外合适的条件下可以分化成为功能性肝细胞,这可以促进体内肝脏整合。干细胞诱导分化而来的功能性肝细胞可以大量生产用于肝衰竭的临床治疗。
在各类人工肝装置中,以体外培养肝细胞作为生物成分的新型生物人工肝被认为是最有前途的,己在动物实验及临床应用中取得了较好的疗效8。生物反应器生物人工肝的核心部分,其性能直接关系到人工肝支持的效率与效果。它的主要功能是:①为肝细胞提供良好的生长代谢环境。②作为患者血液(血浆)与肝细胞相互作用、进行物质交换的场所。国外学者一直非常重视生物反应器的研究,相继提出多种设计思想与方案,使其性能不断改进。目前生物反应器主要有4种:中空纤维反应器、灌注床/支架反应器、片层平板系统、微囊悬液式,下面就这几种进行详细介绍。
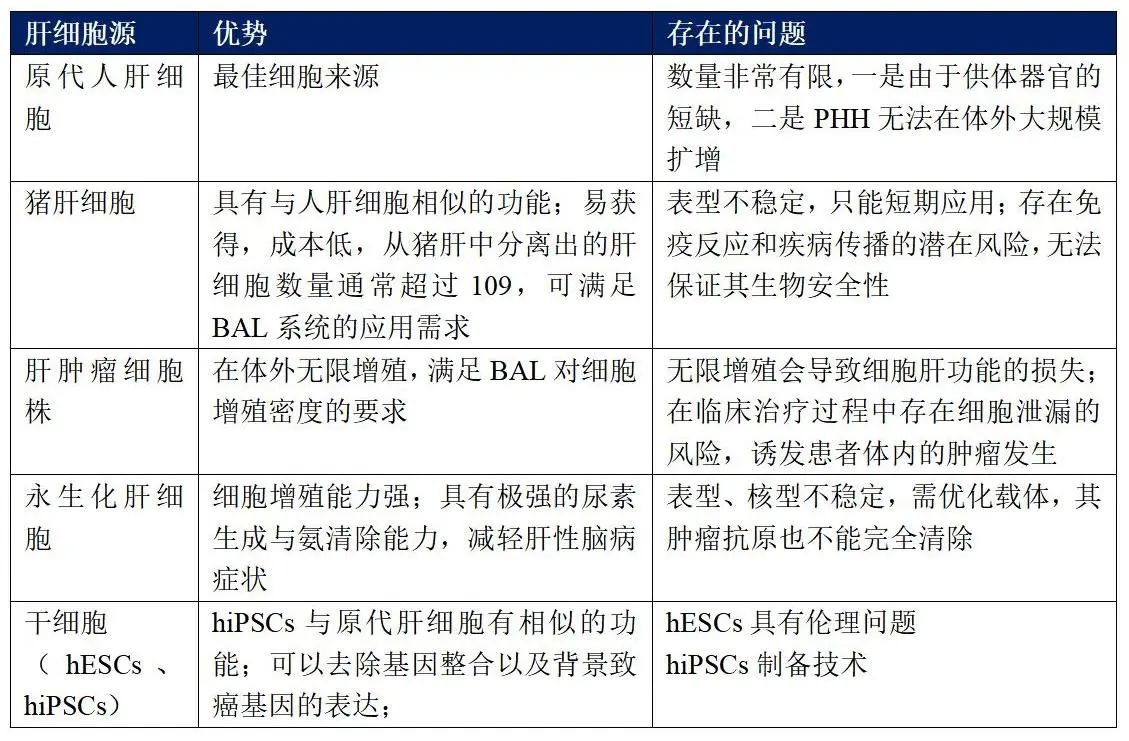
中空纤维型生物反应器在物质传输和免疫阻隔方面具有明显的优势,使其成为体外生物人工肝支持系统中使用最多的生物反应器9(如图所示)。其类型包括普通型中空纤维管生物反应器、复合型中空纤维管生物反应器和编织型中空纤维管生物反应器集中类型,下面就普通型中空纤维管生物反应器进行详细说明。
图 中空纤维反应器
普通型中空纤维管生物反应器:该反应器由成百上千根多孔空心毛细纤维管组成,纤维呈平行排列,置于一圆柱形密闭仓内,在纤维管半透膜内外形成两个独立的腔隙,即管内腔和管外腔,分别用于培养肝细胞或血液循环灌注。培养肝细胞与ALF患者血液处于隔离状态,患者血液/血浆由管内通过时,肝细胞与患者血液之间进行物质传输与交换。但普通中空纤维型反应器的结构决定了反应器内的肝细胞分布难以均匀,细胞黏附性能较差,液体弥散受到一定程度的限制。
灌注床/支架生物反应器是一类将肝细胞培养于固定化三维支架的反应器 (如图所示)。在灌注培养条件下,患者血浆能与肝细胞直接接触,从而达到治疗的目的。有人采用网状聚乙烯醇缩甲醛树脂探究了一种BAL反应器用于鼠肝细胞高密度培养和代谢功能的维持。结果发现,经过7d培养,灌注培养条件下肝细胞的氨代谢速率、尿素合成速率和白蛋白分泌速率分别达到0.0948mM/h、0.165mM/h和1.15µg/h/mL,明显优于静态单层培养 。

图 灌注床/支架生物反应器
De-Bartolo等10设计出一种平板膜式生物反应器(如图所示),共计20层氧通透性平板网格式薄膜被平行排列于反应器内,每层膜的氧通透面积为115 cm2,可种植2×108个猪肝细胞,反应器内最多可放置50层网格式膜,细胞总数可达1×1010
以上,各层膜之间平行排列、相对独立,增加膜的数量不影响反应器的结构,可根据人工肝支持的需要随时调整。通过检测DNA含量证实,在培养的第1天细胞数即明显增加,同时伴白蛋白、尿素含量的增加。由于该反应器不仅充分考虑了重建肝组织结构,达到高密度培养肝细胞的目标,而且提供了与体内相近的微环境,使肝细胞保持特殊的肝功能。

图 片层平板反应器
微囊/流化床生物反应器是将肝细胞用一种半透膜材料包裹而制成的多孔微囊,继而进行悬浮培养的一类反应器。近年来,有研究者尝试构建微囊/流化床生物反应器(如图所示)。海藻酸钠具有良好的生物相容性且易凝胶化,因而被广泛用作肝细胞微囊制备的材料11。Lv等采用海藻酸钠-壳聚糖包埋原代猪肝细胞,构建一种流化床生物反应器,并通过肝衰竭猪模型评价其解毒能力。经过24h后,实验组猪血浆中的乳酸含量和间接胆红素含量显著低于未处理组或假处理组 (未填充肝细胞的空囊 );同时,实验组的血糖含量和Fisher指数显著高于对照组;并且实验组猪的存活时间远大于对照组。因此,基于海藻酸钠-壳聚糖微囊 的流化床生物反应器显示出缓解猪肝衰竭疾病症状且延长存活时间的作用。
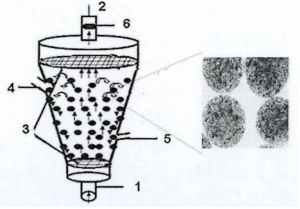
图 流化床生物反应器

小结:
当前临床上主要应用的人工肝是非生物型人工肝,其通过滤过、吸附和血浆置换肝衰竭患者血液中的毒素,来改善临床表现。不过,同济大学附属东方医院承办的《医学参考报》指出,多项临床试验表明,非生物人工肝系统不能降低急性肝衰竭死亡率。
而生物人工肝则是将患者血浆通过体外循环与生物反应器中的人肝细胞进行物质交换,短时间替代肝脏工作,并促进受损肝脏再生修复,性能上更接近人体肝细胞。基于此,肝细胞和反应器是生物人工肝的两大核心要素。相较于动物源性肝细胞、肿瘤源性肝细胞等种子细胞,原代肝细胞理论上最接近人体肝细胞,是最理想的选择12,但其存在来源不足,提取困难,难以大批量体外培养的难题。针对生物人工肝的细胞来源探索还需要更多的临床研究。
排版:大大怪
医疗器械、新材料、人工智能;
一定技术壁垒



