近日洛桑联邦理工学院Jocelyne Bloch等人在Nature杂志上发表了题为The neurons that restore walking after paralysis文章,区分出了神经康复过程中发挥重要作用的神经元SCVsx2::Hoxa10。主要研究内容如下。
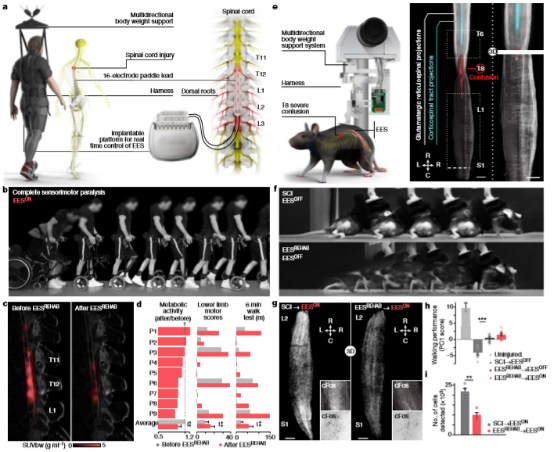
脊髓损伤中断了从大脑和脑干投射到腰椎脊髓的通路,导致瘫痪。本研究显示,在神经康复期间应用腰脊髓的硬膜外电刺激(EES)恢复了9例慢性脊髓损伤患者的行走能力。恢复还包括行走时人类腰椎脊髓神经元活动的减少。作者猜测神经元活动的减少反映了特定神经元亚群的活动依赖选择性,这对脊髓损伤后的患者行走至关重要。为了识别这些特定的神经元,该团队在小鼠中建立了EESREHAB的技术和治疗特征模型。他们将单核RNA测序和空间转录组学应用于这些小鼠的脊髓中,用以绘制瘫痪恢复的具有空间分辨能力的分子图谱。然后,利用细胞类型和空间优先顺序来识别与行走恢复有关的神经元。
虽然这些神经元对脊髓损伤前的行走不需要,但团队证明了它们对脊髓损伤后EES的行走恢复是必不可少的。增强这些神经元的活性可使EESREHAB恢复行走能力,而消融这些神经元则阻止了中等脊髓损伤后自发的行走能力恢复。因此,他们确定了一个脊髓损伤恢复的神经元亚群,它对瘫痪后恢复行走是十分必要的。此外,他们建立了一个使用分子制图法来识别产生复杂行为的神经元的框架。
协调行走的神经元位于腰椎中。为了行走,大脑发送下行指令来激活这些神经元。严重的脊髓损伤(SCI)导致通道受损。虽然位于腰脊髓的神经元不会受到直接损伤,但指令不能正常下达,后果同样是永久性瘫痪。
有相关研究表明,EES可以立即激活腰椎脊髓中的无功能神经元,使瘫痪患者能够行走。在神经康复期间应用EES(EESREHAB)可以进一步改善行走的恢复。EESREHAB能够恢复行走的生物学原理仍然未知。所以团队先假设了EESREHAB会参与重塑脊髓中的重要但尚未识别的神经元,这些神经元是瘫痪后行走所必需的。
EESREHAB(神经康复过程应用EES)重塑人类脊髓
该团队首先测试了EESREHAB能否恢复大量SCI患者行走,以及这种恢复是否涉及到腰椎的重塑。
九名受试者参加了一项人体临床试验“地面刺激运动”(STIMO)(clinicaltrials.gov:NCT02936453;),目的是确定EESREHAB的安全性和可行性,以便改善慢性SCI患者的行走恢复。前六名参与者表现为严重或完全的运动瘫痪,但他们的腿都有一定程度的感觉。其他三名参与者表现为完全感觉运动麻痹。前六名受试者植入了一根重新调整用途的桨状导线,该导线最初用于治疗神经性疼痛,后三名受试人员植入了一条新设计的、专门构建的桨状引线,该导线主要放在参与行走的胸、腰和骶背根的神经元集合。
仿生EES能够立即使所有9名参与者提高或恢复行走能力。此外,包括两名完全感觉运动麻痹的参与者在内,当EES打开时,他们可以对自己的步幅进行意志控制。
参与者接受了为期五个月的EESREHAB,包括站立、行走和每周与EESON进行四到五次的各种锻炼。随着时间的推移,负重能力显著提高,使参与者能够使用EESON和辅助设备在户外行走。在用EESREHAB之前表现为有残存功能的参与者的下肢运动得分明显增加,即使在没有EES的情况下,四名参与者的行走也能有恢复。
运动能力持续恢复表明EESREHAB重塑了脊髓。该团队推测,这种重塑肯定会反映在行走过程中神经元的活动中。为了解答这个疑问,他们使用18F-氟脱氧葡萄糖(FDG)摄取(18FDG-PET)的正电子发射断层扫描(PET)来量化EESREHAB前后脊髓对行走的反应的代谢活性。步行引起腰椎节段内的明显活动。出乎意料的是,EESREHAB导致了这种活动的减少。因此腰椎脊髓中神经元活动的减少支持了以下假设:EESREHAB控制了特定神经元亚群的活动依赖性选择,这些亚群对瘫痪后行走至关重要。
该团队首先在小鼠中进行了试验。 小鼠接受了严重的中胸挫伤,复制人类SCI最常见的情况。病毒介导的神经束追踪结合CLARITY优化的光片显微镜显示,损伤下方的皮质脊髓束纤维完全中断。属于SCI引起的永久性瘫痪。
当EES打开时,老鼠立即恢复了支撑时行走的能力。为了模拟在EES开启时观察到的人类行走的自发调节,团队使用光遗传学来操纵运动皮层投射神经元的活动。发现了在EES期间激活运动皮层神经元会导致台阶高度立即增加,并随着激光强度的增加而增加
另外团队对cFos进行了全脊髓标记,cFos是神经元活动诱导的转录因子。穿过腰椎的时候,显微镜能够自动检测cFos,检测发现,与未进行EESREHAB的小鼠相比,接受EESREHAB的小鼠的cFosON神经元数量明显减少。
团队认为识别与EESREHAB结合并重塑的神经元亚群将需要一个图谱,该图谱将每个神经元亚群的分子反应分类为EESREHAB的关键治疗特征。为了制作这张图谱,团队利用单细胞核RNA序列(snRNA-seq)技术、空间转录组学、多重RNAscope技术,建立了单细胞水平的空间分布图谱,并能够以单细胞分辨率对脊髓进行检查。腰椎的单细胞水平图谱建立了一种分子地图,可用于识别瘫痪后恢复行走的未知神经元。
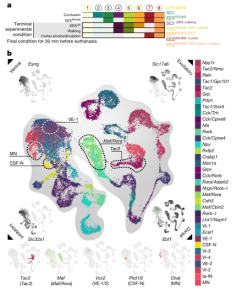
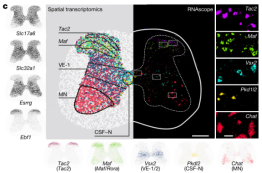
图 EESREHAB的分子制图
团队利用该图谱来识别EESREHAB治疗相关的神经元亚群。基于一种名为Augur的机器学习方法识别了在生物干扰下变得更加转录可分的细胞类型。借助这种方法确定了EESREHAB治疗相关的神经元亚群——腰髓中间神经元(SCVsx2::Hoxa10)。并且团队基于开发的Magellan工具,验证了脊髓中间带会响应行走且SCVsx2::Hoxa10神经元恰好分布在这里。
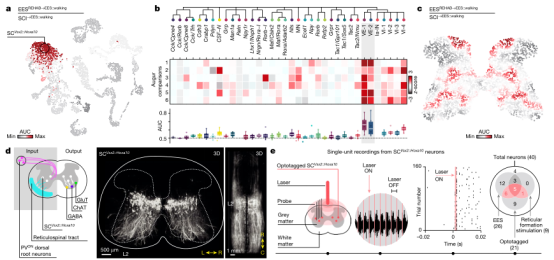
图 识别恢复神经元的分子探针
跨突触追踪显示,SCVsx2::Hoxa10神经元从位于背根神经节(PVON)的表达小白蛋白的神经元的大直径传入以及位于vGi的神经元接收直接突触投射。团队发现EESREHAB增加了大直径传入纤维和网织脊髓纤维向SCVsx2::Hoxa10神经元的突触投射密度。团队还发现,SCVsx2::Hoxa10神经元仅投射到腹侧脊髓,在腹侧脊髓中,它们与52%的谷氨酸能(GluTON)、77%的GABA能(GABAON)和56%的胆碱能(ChATON)神经元建立紧密的突触同位。SCI诱导SCVsx2::Hoxa10神经元到腹侧GABAON神经元的突触同位密度显著降低。另外,尽管经历EESREHAB的小鼠在行走过程中cFosON神经元的数量显著减少,团队发现EESREHAB后SCVsx2::Hoxa10神经元的这种转录活性增加了一倍。
另外,团队量化了施加EES脉冲后腿部肌肉的反应。发现EESREHAB在小鼠和人类中都消除了脊髓对EES的反应。为了评估SCVsx2::Hoxa10神经元是否对这些反应有贡献,团队使用化学遗传学来操控它们的活动。EESREHAB后,SCVsx2::Hoxa10神经元的失活现象复制了慢性SCI小鼠中观察到的异常反应,而SCI小鼠的激活则消除了这些反应。
因此得出结论,SCVsx2::Hoxa10神经元具有与EESREHAB的关键治疗特征相兼容的解剖学和功能特性。
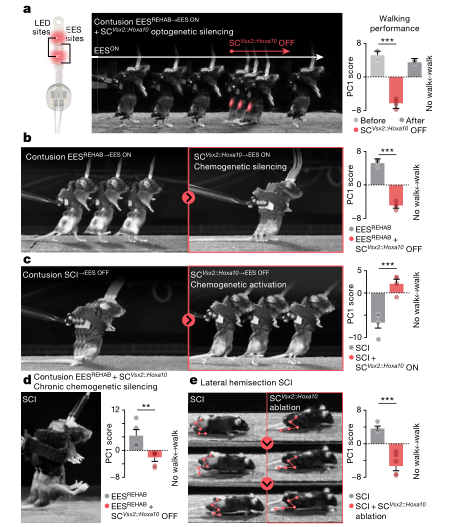
团队进一步验证了SCVsx2::Hoxa10神经元对于EESREHAB恢复行走能力的充分性与必要性。
团队首先测试了SCVsx2::Hoxa10神经元是否对健康小鼠的行走产生是必要的。光、化学方法失活以及靶向消融SCVsx2::Hoxa10神经元对基本行走没有明显影响。进一步的脊髓光遗传学EES试验表明,SCI小鼠中SCVsx2::Hoxa10神经元的光失活会立即抑制了EES的行走,相反,激活可以恢复其行走能力。患有慢性麻痹的SCVsx2::Hoxa10神经元的激活立即恢复了行走,无论EES是打开还是关闭。反过来,在没有EES的情况下进行康复的小鼠中,SCVsx2::Hoxa10神经元的导致行走恢复,与接受EESREHAB的小鼠相似。
进一步,团队用SCVsx2::Hoxa10神经元的持续化学遗传沉默方法验证了这些神经元的长期沉默会阻止EESREHAB的恢复。
最后,团队研究了SCVsx2::Hoxa10神经元的消融是否损害了脊髓侧半切后自然发生的行走恢复后发现,在腰椎脊髓中缺乏SCVsx2::Hoxa10神经元的情况下,小鼠在侧半切SCI后无法完全恢复行走。
以上试验证实,SCVsx2::Hoxa10神经元的参与是瘫痪后行走恢复的基本条件。
SCVsx2::Hoxa10神经元是瘫痪后恢复行走所必需的
该研究显示EESREHAB恢复了行走,改善了9名慢性SCI患者的神经状态。这种恢复证明了EESREHAB对SCI后出现神经功能缺损的大量患者的治疗效果,从而为临床应用该疗法开辟了道路。结合进一步小鼠相关研究的结果,该团队证明了SCVsx2::Hoxa10神经元在协调瘫痪恢复中的重要作用。
另外,了解每个神经元亚群对复杂行为(如行走)的贡献是神经科学的一个基本挑战。该团队提出了Augur和Magellan联合方法,来界定生物干扰优先反应的细胞和空间起源,为单核和空间转录组中的应用提供了一个通用的框架,可用于识别特定行为的关键神经元。
相关链接
https://doi.org/10.1038/s41586-022-05385-7
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正,资料内容侵删。
排版:大大怪