前沿速递丨肿瘤特异性治疗新思路:基于生物活性蛋白和光热剂结合的纳米杂合体用于肿瘤协同增强治疗
发布时间:2023-01-28 09:02:32浏览次数:
2022年10月,江南大学孙山教授团队发表题为“Biomolecule-based stimuli-responsive nanohybrids for tumor-specific and cascade-enhanced synergistic therapy”的研究。该团队开发了一种生物活性蛋白和光热剂结合的纳米杂合物,其具有较好的生物相容性和生物可降解性,既可以有效根除实体瘤又可以抑制转移瘤的生长。
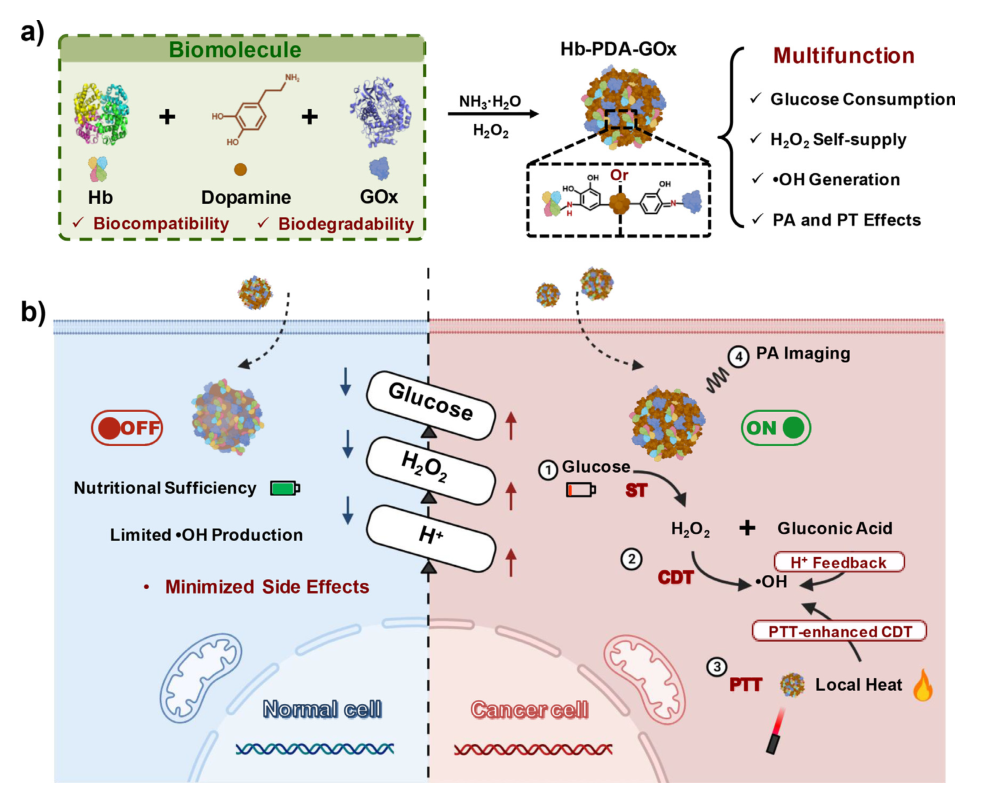
在肿瘤治疗过程中,由于纳米治疗制剂的特异性差而导致严重的副作用和差强人意的治疗效果。在本文中研究团队设计制造了一种具有多种刺激响应性的纳米杂合体,Hb-PDA-GOx,用来增强肿瘤特异性治疗。
该纳米杂合体包含两种蛋白质(血红蛋白(Hb)、葡萄糖氧化酶(GOx))和一种光热剂聚多巴胺(polydopamine, PDA),其在肿瘤微环境(tumor microenvironment , TME)中可选择性地表现出级联催化活性,具体表现为:GOx将体内过表达的葡萄糖催化为葡萄糖酸和过氧化氢(H2O2),切断了癌细胞的营养供应;Hb将H2O2转化为毒性物质羟基自由基(•OH)用于化学动力学治疗(tumor microenvironment , CDT);PDA的局部发热可以通过光热疗法(photothermal therapy , PTT)增强CDT的功效。团队已经通过体外和体内实验进行验证,证明Hb-PDA-Gox可以有效根除实体瘤,并显著抑制转移瘤的生长。
多功能纳米药物的研究为临床中肿瘤的治疗提供了一种新的思路,但是由于纳米制剂对肿瘤的特异性差,导致药物的释放时间和位点出现偏差,进而影响其对肿瘤的治疗效果。
刺激响应纳米平台的出现有效解决了纳米药物的对肿瘤的特异性,该平台在外部物理刺激和内部肿瘤微环境的辅助下显示出良好的抗肿瘤效果。目前常用的外部物理刺激包括辐射、微波、磁力、超声波和光等,这些外部刺激可以使得药物精确定位肿瘤。特定的肿瘤微环境包括缺氧、低pH等,在保护正常细胞的同时,可实现纳米药物对癌细胞的特异性损伤。当前,刺激相应纳米药物平台的主要问题在于其生物相容性和生物降解性较差。
而天然生物分子,如核酸、肽、蛋白质和生物分子,通常具有较好的生物相容性和生物可降解性,并且具有固有的刺激响应生物活性,可考虑用作智能纳米平台的制备。作者基于该思路,制备了Hb-PDA-GOx纳米杂合体并验证了其对肿瘤的特异性治疗。
Hb-PDA-GOx制备方案:团队将血红蛋白(Hb)、多巴胺盐酸盐(PDA)和葡萄糖氧化酶(Gox)完全溶解在水中,并加入氢氧化铵溶液(NH3·H2O)和H2O2(1M),后将溶液在30°C下轻微搅拌孵育24小时,过滤纯化得到最终产物Hb-PDA-Gox,其合成方式如下图所示:
其中血红蛋白(Hb),是红细胞中的一种天然蛋白质,其在酸性的肿瘤微环境下可与H2O2反应,生成生物毒性物质羟基自由基(•OH),提供化学动力学治疗,但由于人体内H2O2并不充足,导致治疗效果较差;葡萄糖氧化酶(Gox),它可以有效地将肿瘤内葡萄糖转化为葡萄糖酸和H2O2,消耗葡萄糖的含量,一方面减少肿瘤细胞的营养物质,另一方面为血红蛋白提供足够的H2O2。聚多巴胺(PDA),是一种特殊的光热剂,具有良好的NIR吸收和高光热转换能力,同时具有优异的生物相容性、亲水性和生物降解性,可用作纳米复合材料的保护层。因此,将天然存在的Hb和GOx组合加强治疗效果。此外,近红外(NIR)激光照射等外源刺激也可以在光热剂的辅助下增强CDT效应。
在正常细胞中微环境呈碱性,构建的Hb-PDA-Gox不会反应产生毒性物质;但在肿瘤细胞中其微环境呈酸性,构建的Hb-PDA-Gox可在酸性环境下反应生成•OH杀伤肿瘤细胞,此外,在激光的作用下能够增强反应,强化作用效果(如下图所示)。
团队前期的实验中已经验证了Hb-PAD-Gox在体外的作用效果,后续实验主要验证其在小鼠体内的实验结果。
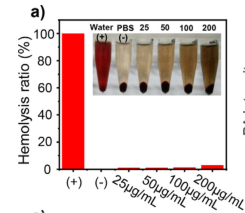
由于实验需要在动物体内进行,为了保证Hb-PAD-Gox在体内的安全行,需要通过溶血实验评估其血液相容性,实验采用水作为阳性对照、PBS作为阴性对照,实验组为不同浓度(25–200μg/mL)的Hb-PAD-Gox,观察溶血现象,结果发现在不同浓度的Hb-PAD-Gox组之间的溶血率均低于5%的标准水平(部分上清液颜色浑浊是因为有游离的Hb)(如图),表明设计的杂合物具有良好的血液相容性,不会导致溶血的发生。
(二)Hb-PAD-Gox对实体瘤的治疗及转移抑制作用效果
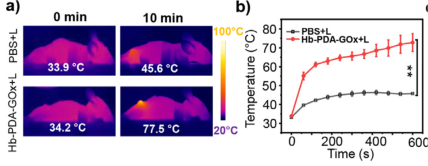
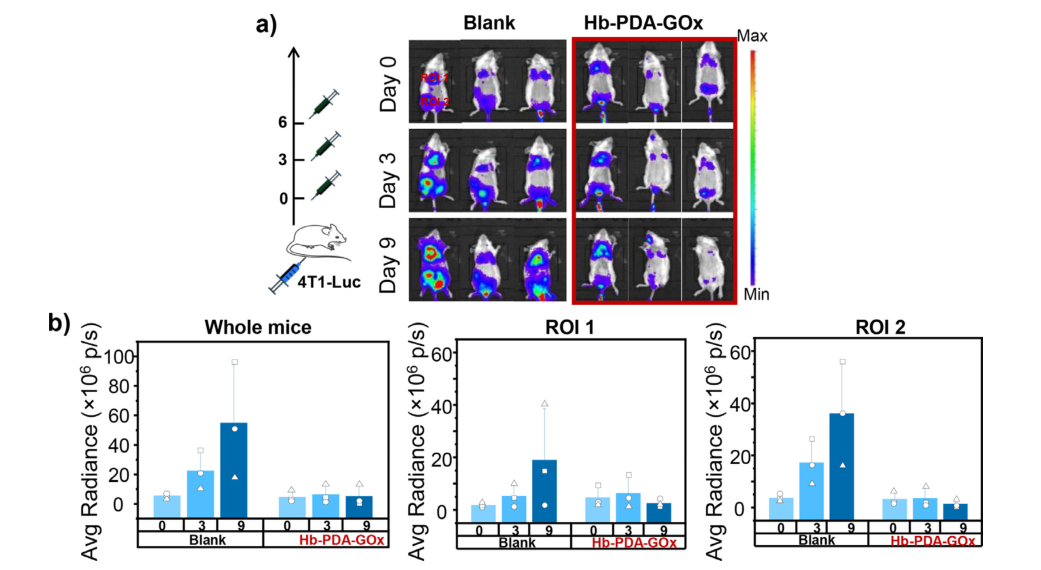
1、实验通过构建实体瘤模型研究Hb-PAD-Gox在体内的治疗效果,实验将4T1细胞皮下注射到小鼠大腿上部,并将小鼠随机分成2组,PBS组(空白组)和不同浓度(25–200μg/mL)Hb-PDA-GOx(100μL,2 mg/mL)的实验组,将Hb-PAD-Gox静脉注射到小鼠体内,8小时后通过808nm的激光照射10分钟,观察小鼠体内肿瘤微环境的温度(小鼠的热图像),结果发现肿瘤处温度在60秒内迅速升高至55.1°C,并在记录结束时达到72°C;PBS组肿瘤温度仅在照射10分钟后升高至45.6°C(当温度升至50°C左右时,形成的微血管血栓和缺血会导致可逆性细胞死亡),表明Hb-PAD-Gox能够达到杀伤细胞的治疗效果。
2、与上组实验(实验2)实验组设计相同,观察小鼠体积的变化,结果发现与PBS+NIR激光组(空白组)相比,Hb-PDA-Gox + NIR激光治疗的小鼠中发现肿瘤完全消除,表明Hb-PDA-Gox 和 NIR之间的协同治疗效果。
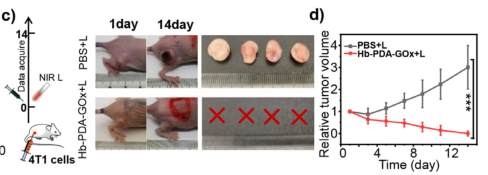
3、为了评估Hb-PDA-Gox对实体瘤转移的抑制作用,通过免疫荧光染色(TUNEL染色、Ki67染色)和苏木精-伊红染色(H&E染色)观察肝切片和肺切片,结果发现与PBS+NIR (对照组)相比,Hb-PAD-Gox+NIR(实验组)中发现大量凋亡细胞(通过末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)测定估计)和显著降低的Ki67(肿瘤细胞增殖标记物),此外通过H&E染色图像几乎没有发现明显的疾病组织,表明Hb-PAD-Gox和NIR的协同治疗不仅有效地消除了实体瘤,还降低了远处转移的风险。
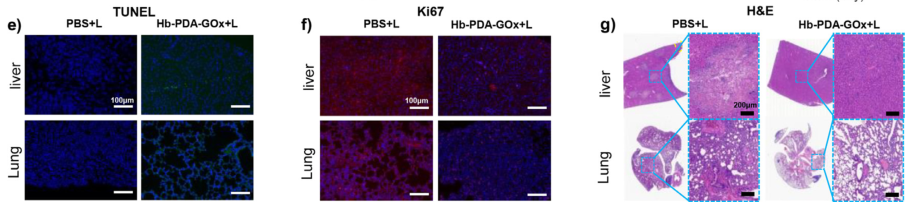
受实体瘤转移的抑制作用启发,团队进一步对转移肿瘤模型进行研究,该模型通过向小鼠体内(大腿上部)注射表达荧光素酶的癌细胞(4T1Luc)而建立,结果发现PBS(空白组)中小鼠体内快速增加的肿瘤生物发光,而Hb-PAD-Gox组显示出抑制的生物发光信号(a图);
对该小鼠模型随机选定的区域(ROI 1为肺部转移、ROI 2为腹部转移)观察信号强度的变化,并进行定量分析,结果发现不管是肺部转移还是腹部转移,实验组的信号强度均低于对照组,且时间越久对比越明显,表明Hb-PAD-Gox能够有效抑制体内肿瘤转移。
作者通过Hb和GOx原位交联制造的智能多反应治疗纳米平台(即Hb-PDA-GOx),可通过饥饿处理、化学动力和光热协同治疗,达到治疗肿瘤的效果,所构建纳米平台的生物分子具有理想的生物相容性和生物可降解性,有望解决纳米药物开发中的问题。基于肿瘤微环境触发的GOx和Hb级联催化反应,以及饥饿治疗和H2O2提供的化学动力学治疗可特异性靶向癌细胞。该研究提供了一种既能放大治疗效果,又能最小化副作用的纳米杂合体,未来将有希望应用于同类纳米药物的临床转化。
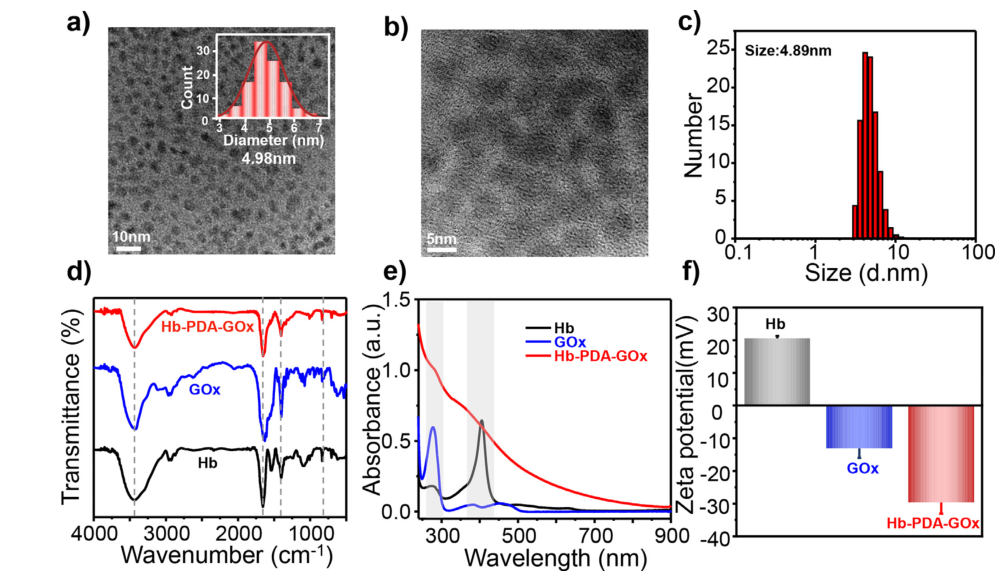
图 a)TEM图像;b)Hb-PDA-GOx的高分辨率TEM图像;c)水介质中Hb-PDA-GOx的流体动力学直径分布直方图 ;d)FT-IR光谱;e)UV-vis吸收光谱和;f) Hb、GOx和Hb-PAD-Gox的ζ电位。
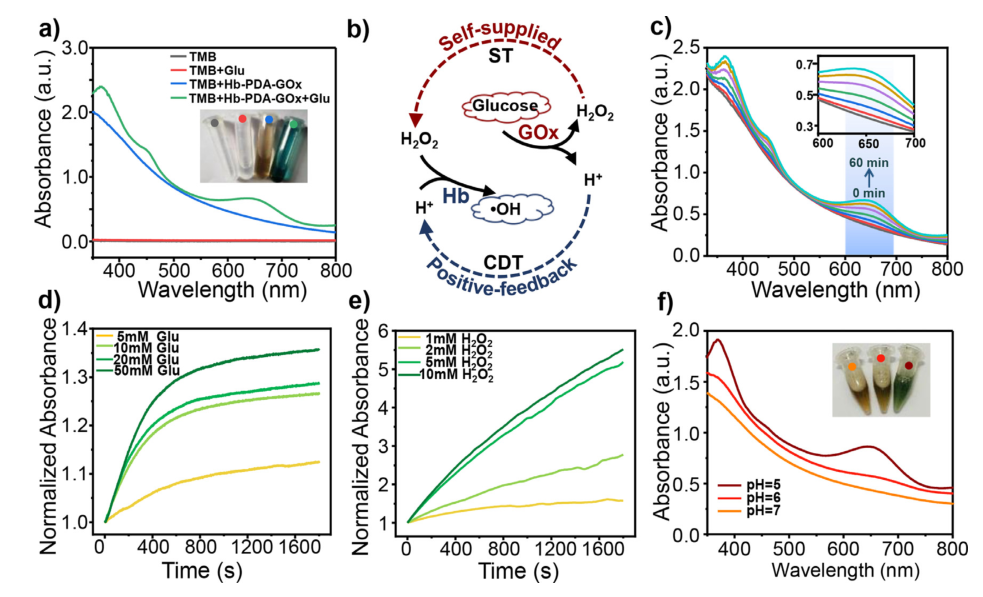
图 a)TMB、TMB+葡萄糖、TMB+Hb-PDA-GOx以及磷酸盐缓冲液(PB)+ TMB+葡萄糖+ Hb-PDA-GOx的UV-Vis光谱;b)Hb-PDA-GOx的TME响应级联催化示意图;c)在不同时间点加入葡萄糖后TMB和Hb-PDA-GOx的混合物的UV-Vis光谱;d)添加不同浓度的Hb-PDA-GOx和葡萄糖TMB时,在652 nm处TMB的典型吸收与孵育时间的函数关系;e)添加不同浓度的Hb-PDA-GOx和H2O2时,在652nm处TMB的典型吸收与孵育时间的函数关系;f) TMB、Hb-PDA-GOx和葡萄糖混合物在不同pH值下的UV-Vis光谱
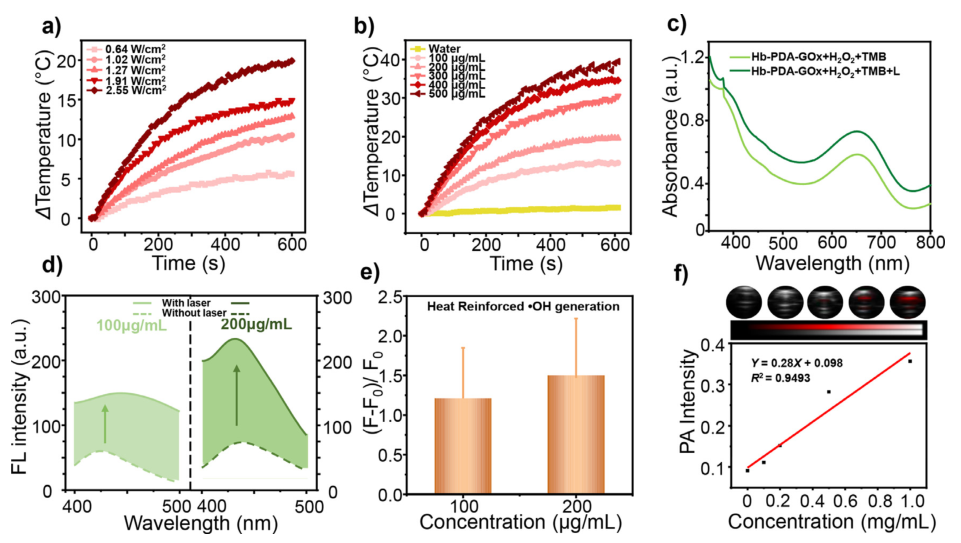
图 a) 在不同功率剂量的激光照射(808nm,10min)下,Hb-PDA-GOx水溶液的温度变化曲线;b)在2.55 W/cm2(808 nm,10分钟)的激光照射下,不同浓度的Hb-PDA-GOx水溶液的温度变化曲线;c)TMB、Hb-PDA-GOx和H2O2的混合物在有/无激光照射的情况下的UV-Vis光谱(pH=5.5,PB;808 nm,10分钟,2.55 W/cm2;L表示“有激光照射”);d)不同浓度的TA、H2O2和Hb-PDA-GOx的混合物在有/无激光照射(pH=6.3,PB;808 nm,10分钟,2.55 W/cm2)下的荧光发射光谱,以及;e)相应的定量结果,其中F0和F是激光照射前后TA的荧光强度;f)不同浓度下Hb-PDA-GOx的PA信号强度(λex=685nm)
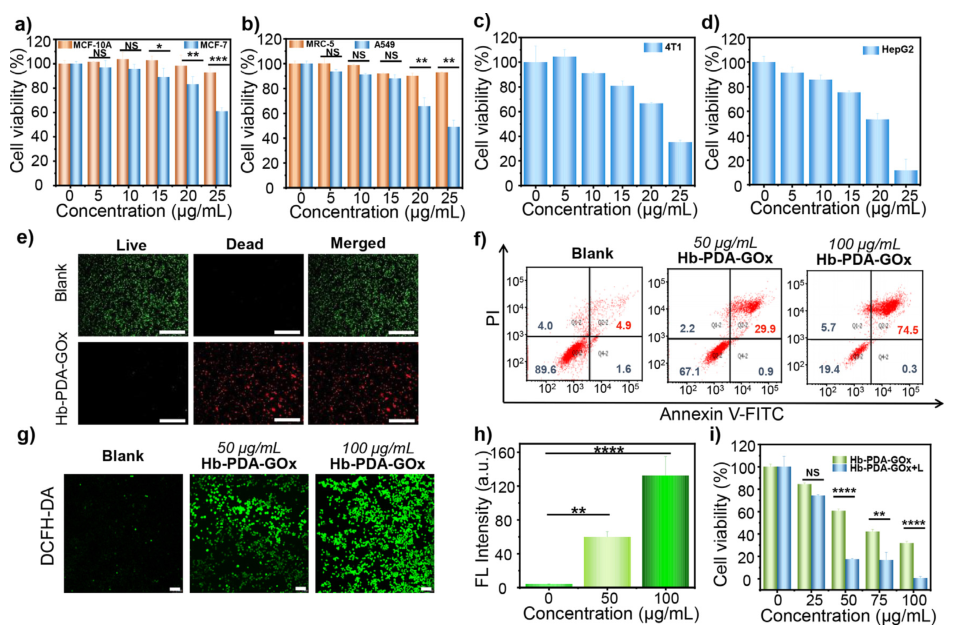
图 (a-d)正常细胞(MCF-10、MRC-5)和癌细胞(MCF-7、4T1、A549和HepG2)在不同浓度(5-25μg/mL)的Hb-PDA-GOx孵育24小时的细胞存活率;f) 4T1细胞分别用不同浓度(50和100μg/mL)的PBS和Hb-PDA-Gox处理4小时的流式分析图;g)用DCFH-DA预染色的4T1细胞并分别用不同浓度(50和100μg/mL)的PBS和Hb-PDA-GOx处理4小时后的共聚焦激光扫描显微镜(CLSM)图像,以及;(h)相应的定量结果;i)在有/无NIR激光照射(808 nm,2.55 W/cm2,10分钟)的情况下,不同浓度Hb-PDA-GOx(50–100μg/mL,4小时)孵育4T1细胞的存活率。
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正,资料内容侵删。
排版:大大怪