
丨植入式神经刺激器的结构及组成

整个系统由神经刺激器、电极、延伸导线以及患者体外的程控仪组成,其中直接发挥治疗作用的是植入体内的部分。
① 神经刺激器
一般植入在患者胸前皮下部位,可分为可充电与不可充电两种类型,能够按照患者或医生通过程控仪的设置发射脉冲刺激信号,以发挥治疗的作用。
② 延伸导线
用于连接电极与刺激器,具备一定的延展性,以提高患者进行扭转头部的动作舒适度。
③ 电极
与铅笔芯粗细相同,其尖端有一个或多个电极触点,电极触点通过医生手术植入的方式,被放置在特定的神经核团上,利用一个或多个触点组合来传播电刺激信号。
④ 患者程控仪
结构与功能均比较简单,按键较少,患者可在家中实现在医生设定的安全范围内微调神经刺激器的参数
⑤ 医生程控仪
操作与结构较④患者程控仪更为复杂,医生可根据此仪器,以无创的方式来检查神经刺激器的工作状态,同时可以按照病情与患者反应来调整合适的信号输出频率与参数,另可获知植入式神经刺激器的电池使用情况。
丨植入式神经刺激器原理
体外控制器和植入体两个部分通过无线通信方式实现现行传递。
工作原理:通过体外控制器选择刺激信号波形,经无线通信模块向植入体发送刺激信号的波形类型等参数信息,而植入体接收到相关参数,经信号控制模块产生相应的控制信号指导刺激信号发生模块产生频率、极性、脉宽、强度等可变的刺激信号,最后通过生理电极阵列对神经进行刺激,同时植入体通过无线通信向体外控制器返回其工作状态,并在体外控制器予以显示。

图 2 体外控制器系统架构图

图 3 植入体系统架构图
随着近几年微电子和微纳米技术的高速发展,电路的规模从超大规模发展到片上系统,相应的植入式神经刺激器实现了与神经信号检测处理电路和神经刺激电路混合集成或单片集成。
核心技术包括:
•低功耗植入式集成电路设计技术
•RF射频电路的设计技术
•植入式系统的能量供给技术
•集成电路中微弱信号的提取技术
•数字信号处理技术
•植入式天线设计
•传感技术和神经电极技术
•植入式系统的制作与封装技术
丨产品分类
1、DBS
“深度脑刺激”(Deep brain stimulation, DBS),DBS技术是一种对大脑进行可逆性调控的手段,它通过手术将电极植入到大脑特定脑区,发送一定频率的电脉冲,对异常的大脑放电进行调控,从而达到改善或治疗疾病的目的。由于DBS的整个系统包括电极、脉冲发生器和导线,和心脏起搏器类似,因此DBS又被称为“脑起搏器”。
现代脑起搏器由Brice教授发明,其脉冲发生器通过手术方式植入患者的锁骨皮下,导线通过皮下走形进入大脑,一对刺激电极位于颅内,又称中枢型脑起搏器[1]。目前在临床上应用DBS的患者多属于帕金森晚期病人,临床诊疗流程为早期使用药物控制,当药物作用下降和病程进展到后期时选择植入DBS进行治疗。
DBS治疗包括手术植入DBS设备与术后程控两部分。手术较为复杂,需要多个植入硬件设备进行配合操作,同时对医生的要求较高,主要包括术前核磁定位计算靶点坐标、术中电生理信号记录确定靶点位置、刺激电极植入目标靶点、体外临时电刺激观察患者肢体运动改善情况,临时电刺激有效证明电极置入位置准确,最后植入并链接脉冲发生器,手术结束。术后1个月左右,待病人脑内情况恢复稳定,再用体外程控仪器打开脉冲发生器,设定刺激参数,达到病人满意的治疗效果。术后程控期间,若病情进展或变化,还可以体外遥控调整刺激参数,重新获得满意的疗效。
临床上治疗帕金森病常用的靶点有丘脑底核(STN)、苍白球内侧部(GPi)、丘脑腹中内侧核(Vim)、脑桥核(pedunculopontinencleus,PPN)。丘脑底核(STN)现已成为治疗帕金森的首选靶点[2],STN与GPi是临床治疗肌张力障碍、Meige综合征等运动障碍性疾病的主要刺激靶点,治疗精神疾病常选择伏隔核(nucleusaccumbens,NAcc)。目前认为DBS治疗帕金森病的可能机制有:①DBS能提高纹状体去多巴胺的代谢活性,并增加乙酰胆碱M受体从STN转移到丘脑,提高丘脑乙酰胆碱的浓度;②DBS能增加丘脑、小脑、中脑和皮质区域的血流量;③DBS能抑制从STN到其他靶点投射的谷氨酸神经纤维的活性,降低兴奋性神经元的过度激活;④DBS能对异常STN神经元兴奋性的调控,改变相关的联系核团的异常功能状态,使基底核运动环路正常调控功能重新恢复[3]。
美国Medtronic公司的“脑起搏器”Activa系统于1997年被批准治疗原发性震颤和帕金森震颤,2002年被批准治疗帕金森病,2003年被批准治疗肌张力障碍。北京品驰医疗“脑起搏器”于2013年获批治疗帕金森病,“植入式迷走神经刺激器”于2016年获批治疗癫痫。

图 4 脑起搏器植入及刺激位点示意图
2、SCS
脊髓电刺激(Spinal Cord Stimulation,SCS)是把一根细电极(条状或针状)植入相应阶段的脊柱椎管内的硬膜外腔,紧邻脊髓后柱,将电极与植入髂部皮下的神经刺激器连接,再用电脉冲对脊髓后柱的传导和后角感觉神经元进行刺激治疗,使患者产生麻刺感,起到按摩与刺激作用,可以有效减轻疼痛感。
刺激参数选择:脉宽0.2~0.3ms、频率50~60Hz、电压强度1.5~1.6V,以患者没有感到明显不适为宜。SCS缓解疼痛的确切机制仍不清楚。目前推论的机制有以下几种:①闸门理论学说,即通过植入脊髓硬膜外间隙的电极传递的电刺激,阻断疼痛信号通过脊髓向大脑传递,使疼痛信号无法到达大脑皮质,从而达到控制疼痛的目的;②抑制脊髓灰质背角的广域神经元过度兴奋,有实验表明SCS缓解疼痛影像主要是通过A-β纤维实现;③调节递质水平,SCS能促进灰质后角的P物质、5-羟色胺(5-HT)、去甲肾上腺素、甘氨酸和γ-氨基丁酸(gamma-amino butyric acid,GABA)释放,通过这些递质对疼痛进行调节;④通过一致中枢神经系统,稳定心脏内神经活动,促进腺苷的释放实现缓解心绞痛;⑤通过激活背根的传入纤维从而引起外周降钙素基因相关肽(calcitonin gene-related peptide,CGRP)释放,CGRP能够以前你血管舒张从而缓解缺血性疼痛。
该治疗方法易于控制,被广泛用于临床,美国FDA许可该疗法用于躯干与四肢疼痛治疗。SCS已成为当今临床疼痛领域里的一项重要镇痛技术。全球每年约有8万例进行脊髓电刺激治疗的患者[4],总有效率80%[5]。

图 5 骶神经刺激器植入示意图
3、VNS
迷走神经刺激(Vagus Nerve Stimulation,VNS)由Penry教授发明,其脉冲发生器与DBS类似,也是植入患者左侧锁骨皮下,但导线经皮下走形至迷走神经,又称周围型脑起搏器[6]。VNS通过手术将螺旋式刺激电极触点缠绕与左侧迷走神经主干,将电极与脉冲发生器连接之后。然后在体外调整,设置刺激参数与模式,使刺激器长期、间断式放电刺激迷走神经。
其原理可能是迷走神经分布广泛,通过孤束核投射到丘脑、杏仁核和前脑,并能够经脊髓网状结构到大脑皮质。因此VNS可以调节皮质兴奋性,从而控制癫痫发作。
目前FDA批准的VNS适应症为:使用1~3种抗癫痫药物未能有效控制癫痫发作;部分性发作或部分性发作继发全面性发作;多发病灶或癫痫病灶定位不准。

图 6 迷走神经刺激示意图
4、SNS
骶神经刺激(Sacral Nerve Stimulation,SNS)又称为膀胱起搏器,是将一种弱电脉冲连续施加于特定的骶神经(S3或S4),以此影响神经细胞本身的电生理特性,人为激活兴奋性或抑制性神经通路,调节异常的骶神经反射弧,进而影响和调节膀胱、尿道括约肌和盆底等骶神经支配的区域,调节平衡膀胱的储尿和排尿功能,改善症状。

图 7 骶神经刺激示意图
丨植入式神经刺激器临床应用及并发症
表格1 FDA已批准的适应症

上述适应症仅为目前FDA与CE目前已批准的适应症,但是目前还有很多的适应症在探索之中,如适用DBS的中风康复、创伤性脑损伤、重度抑郁症、痴呆。
并发症:
DBS:DBS植入手术是在颅骨上打开一个小孔,用以植入电极,另外将有源设备(电池、脉冲发生器等)植入皮肤下,因此术中可能会出现脑出血、中风、呼吸衰竭等问题;其术后并发症主要有癫痫发作、急性水肿、脑内出血和肺栓塞等。DBS 术后硬件相关并发症是最常见的非血流动力学并发症,主要有皮肤侵蚀、铅迁移、电极断裂和失效、其他部件断裂和失效以及内部脉冲发生器失效等。另一大类的并发症是植入物都常见的并发症——感染,包含全身感染与植入物感染,已有研究证实其感染率约为1.2%~15.2%[7]。
SCS:SCS并发症的发生率很高,约为35%;虽然发生率很高,但是实质上能够威胁到患者生命的并不多,且随着产品的技术进步,并发症的总发生率会降低。目前主要的并发症与对应比率详见下表:
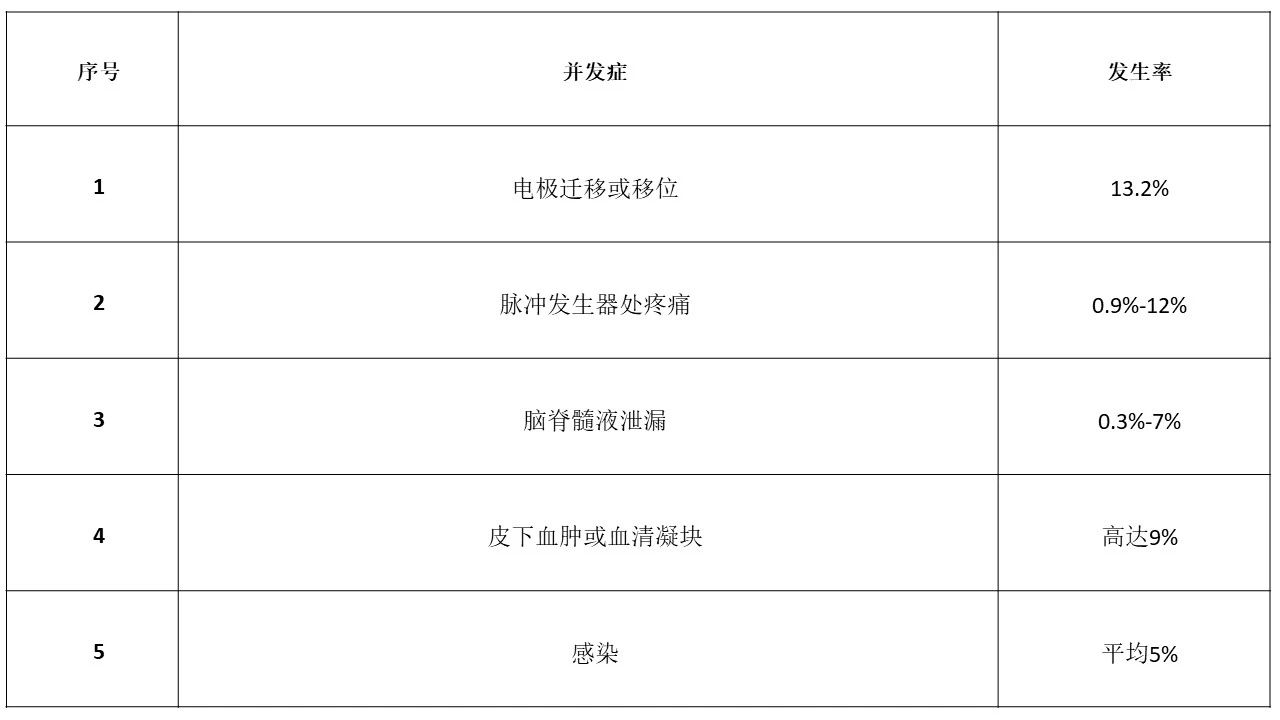
除上表所述的并发症之外,还有一些诸如神经根与脊髓损伤、硬脑膜外血肿、皮肤腐蚀等等不太常见的并发症。
VNS:VNS手术是在患者胸腔皮下植入脉冲发生器,并将电极经由导线引导至迷走神经上。因此在术中,患者可能会出现心动过缓,但发生率极低,约为千分之一[13];其次,术后短期内,可能会出现气道损伤和咽喉功能障碍[14]。在术后的两至三周内激活VNS装置后,患者可能会出现心律失常、声音改变、呼吸困难、咳嗽、睡眠呼吸暂停等并发症[15]。
SNS:FDA总结的SNS植入后的不良事件与并发症有:刺激器植入部位的不良反应,如植入部位疼痛(25.8%)、植入部位感染(10.8%);不舒服的刺激感觉的变化,如触觉异常(12.5%)、刺激感觉的变化(8.3%);排泄功能的不良改变,如尿失禁(6.7%)、腹泻(5%)等等,此外仍有一些发生率较低的,诸如出血、红斑、瘫痪等并发症[16]。
参考文献:
[1]刘海波. 生物医药及高性能医疗器械中国制造2025大众读本[M]. 2018
[2]Cabrera L Y , H Sarva, Sidiropoulos C . Perspectives on the Earlier Use of Deep Brain Stimulation for Parkinson Disease from a Qualitative Study of U.S. Clinicians[J]. World Neurosurgery, 2019, 128.
[3]张建宁主编. 高级卫生专业技术资格考试指导用书神经外科学高级教程精装珍藏本[M]. 2015
[4]国产化脊髓刺激器和骶神经刺激器或将问世,平均每名患者至少节约支出5万元.2017.李路明
[5]脊髓电刺激治疗慢性疼痛新进展.2019.王晓雷
[6]刘海波. 生物医药及高性能医疗器械中国制造2025大众读本[M]. 2018
[7]张宇清, 李建宇, 李继平,等. 运动障碍病脑深部电刺激手术的并发症分析[J]. 临床神经外科杂志, 2016, 13(01):31-34.
[8]Cameron, Tracy. Safety and efficacy of spinal cord stimulation for the treatment of chronic pain: a 20-year literature review.[J]. Journal of Neurosurgery, 2004, 100(3):254-67.
[9]Bendersky D,Yampolsky C.Is Spinal Cord Stimulation Safe? A Review of Its Complications [J]. World Neurosurgery, 2014, 82( 6):1359-1368.
[10]Levy R, Henderson J, Slavin K, Simpson BA, Barolat G, Shipley J, North R: Incidence and avoidance of neurologic complications with paddle type spinal cord stimulation leads. Neuromodulation14:412-422, 2011.
[11]Pedrini L, Magnoni F: Spinal cord stimulation for lower limb ischemic pain treatment. Interact Cardiovasc Thorac Surg 6:495-500, 2007.
[12]Bendersky D,Yampolsky C.Is Spinal Cord Stimulation Safe? A Review of Its Complications [J]. World Neurosurgery, 2014, 82( 6):1359-1368.
[13]Tatum WO IV, Moore DB, Stecker MM, et al. Ventricular asystole during vagus nerve stimulation for epilepsy in humans. Neurology 1999;52:1267-9.
[14]Zalvan C, Sulica L, Wolf S, Cohen J, Gonzalez-Yanes O, Blitzer A. Laryngopharyngeal dysfunction from the implant vagal nerve stimulator. Laryngoscope 2003;113:221-5.
[15]Fahy B G . Intraoperative and perioperative complications with a vagus nerve stimulation device[J]. Journal of Clinical Anesthesia, 2010, 22(3):213-222.
[16]PMA P080025: FDA Summary of Safety and Effectiveness Data
文章来源:和义广业创新平台
转载请注明来源:和义广业网
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正。
作者:易长城
医疗器械、新材料、人工智能;
一定技术壁垒



