
导 读
和义广业【行业分析】之重组胶原蛋白,本篇主要介绍重组人胶原蛋白、重组人源化胶原蛋白、重组类人胶原蛋白3者的概念和区别,以及重组胶原蛋白的几种表达体系。
本篇共 4437 字,阅读时间预计 4 分钟
首先先了解三个概念:
1、重组人胶原蛋白:
由DNA重组技术制备的,在真核细胞中表达人胶原蛋白特定型别基因的完整序列,结构上与天然胶原蛋白一致,有三螺旋结构。生物活性最优;
2、重组人源化胶原蛋白:
由DNA重组技术制备的人胶原蛋白特定型别基因编码的部分氨基酸序列片段,或是含人胶原蛋白功能片段的组合。生物活性次之;
3、重组类人胶原蛋白:
由DNA重组胶原技术制备的经设计、修饰后的特定基因编码的氨基酸序列或其片段,或是这类功能性氨基酸序列片段的组合。其基因编码序列或氨基酸序列与人胶原蛋白的基因编码序列或氨基酸序列同源性低。
2021年3月16日,国家药监局综合司发布了《国家药监局综合司关于《重组胶原蛋白》等2项医疗器械行业标准立项的通知》,于2022年8月颁布的医药行业标准YY/T 1849-2022《重组胶原蛋白》。
2022年4月24日,国家药监局综合司发布了《国家药监局综合司关于<重组人源化胶原蛋白>医疗器械行业标准立项的通知》, 2023年1月,国家药监局正式发布了YY/T 1888-2023《重组人源化胶原蛋白》医疗器械行业标准。
现阶段表达体系中以大肠杆菌、酵母为主,下文主要介绍大肠杆菌和酵母表达体系的优劣势,大肠杆菌、酵母等表达体系缺乏动物细胞中胶原蛋白翻译后修饰,需要添加相对应的重组酶。而植物、杆状病毒、哺乳动物细胞表达体系所产生胶原蛋白含量虽然远低于大肠杆菌、酵母体系,但具有完整的三螺旋结构和较好的热稳定性。不同表达体系的优缺点如下所示:

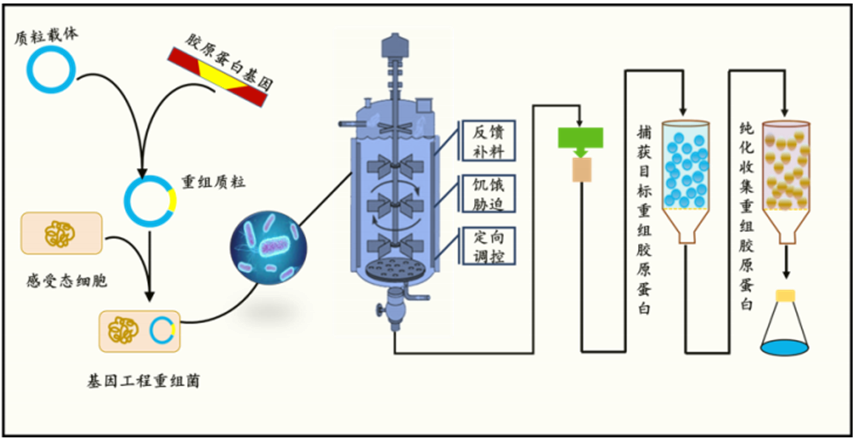
重组胶原蛋白生产的三个环节分别为:1、生物体的筛选与基因改造;2、生物发酵过程控制与参数分析;3、产品分离与纯化
首先,通过基因工程技术从基因层面对生物体进行改造,并导入外源基因以及对特定用途的基因进行强化或弱化,生物体可具备产生其本身不存在或者不生产的物质的能力;
其次,在发酵阶段,发酵过程中通过模拟生物体的生长环境,控制反应参数并对发酵条件进行调整及控制,可以维持发酵条件处在最佳状态,促进生产效率并实现规模量产;
最后,产品的分离与纯化一般是指将最终产物从发酵液或者细胞中分离出来,并形成终端产品;
大肠杆菌是一种中等大小的兼性厌氧杆状细菌,是发展最早、应用最广泛的重组蛋白表达系统之一。大肠杆菌表达系统以大肠杆菌细胞作为宿主细胞,通过含有外源基因表达载体的大肠杆菌细胞表达目标蛋白。根据启动子类型,大肠杆菌表达系统分为 T7、 Lac/Tac 和 PL/PR 等类型。大肠杆菌表达重组蛋白的工艺通常包括基因工程菌的构建、重组蛋白的表达和纯化等步骤(如下图所示),具有操作简便、成本低廉、制备周期短、蛋白表达量高等优势。
大肠杆菌表达体系缺乏使胶原蛋白三螺旋结构稳定的羟基化酶,因此生产重组人胶原蛋白在大肠杆菌大规模化生产遇到挑战。此外,未羟基化胶原蛋白相较于天然羟基化胶原蛋白的Tm值低10 ℃,对于使用大肠杆菌等表达体系高效表达存在重大障碍。一些研究人员通过添加P4H基因以及相应胶原蛋白基因来解决,有研究人员通过在重组序列的 N末端引入 His6-tag 序列,并插入了 V-foldon 域以帮助三螺旋结构折叠1。
毕赤酵母作为真核细胞,与 CHO 细胞高度相似,广泛用于疫苗和药品类蛋白质的生产。与哺乳细胞相比,酵母表达系统价格低廉,表达时间较短的优势,酵母细胞具有生长速度快、能够进行翻译后修饰、可分泌表达和易于遗传操作的特点,是一般公认为安全的菌种(GRAS)。优势如下所示2:
与其他酵母相比,毕赤酵母所翻译加工的重组胶原蛋白具有二硫键、糖基化、蛋白水解过程等优势特征。
虽然酵母工程菌能实现重组胶原蛋白羟基化的过程,但产生的重组胶原蛋白多为同源三聚体(II、III型),对于异源三聚体(如I型)的生产较为困难。
重组胶原蛋白已经在植物系统中成功表达,如玉米(Zea mays) 和烟草植物(Nicotiana tabacum) 中的植物细胞4。通过与羟基化酶共表达能够产生重组I型胶原同源三聚体 (Mr = 70.0–120.0 kDa),但通常外源蛋白表达量低。
Stein 等在烟叶中将人I型胶原蛋白 α1 链和 α2 链编码基因、人源脯氨酸羟化酶和赖氨酸羟化酶基因进行共表达 (Mr = 170.0 kDa),产量为 20 g/L,且羟脯氨酸和羟赖氨酸的含量分别为 7.55%和 0.74%,羟基化程度与天然人I型胶原蛋白非常接近,该技术已被 Collplant 公司 (耐斯兹敖那,以色列) 用来商业化生产重组I型人胶原蛋白用于临床应用的产品中,据报道用于伤口敷料凝胶(VergenixFG) 和用于肌腱治疗相关材料(VergenixSTR) 中5。
利用植物表达体系生产胶原蛋白与其他体系相比,仍具有产量较低、产能不足的缺点。
昆虫杆状病毒表达载体系统 (baculovirus expression vector systems, BEVS) 由杆状病毒表达载体和病毒感染的昆虫宿主组成的二元表达系统,由于其可以对真核蛋白进行翻译后加工等过程而被广泛地用于真核基因的体外表达。而且昆虫是杆状病毒的自然宿主,不会感染其他动物、植物及人类,具有较高的安全性。
Nokelainen 等构建了两株杆状病毒表达系统,其中一株编码II型胶原 α链,另一株编码人 P4H 的 α 和 β 亚基,共转染昆虫细胞后,成功表达了具有稳定三螺旋结构的人II型胶原蛋白 (Mr = 120.0 kDa),表达量达 50 mg/L6。
Qi 等通过将含有人类II型胶原蛋白cDNA 全部基因(4257bp)的BmNPV-pFBDM-IM-col II杆状病毒以注射的方式转染到五龄蚕幼虫背侧血腔。发现家蚕所表达出来的II型胶原蛋白存在着单螺旋α链与三螺旋α链结构,蛋白分子量分别为130 kDa和300 kDa。每个幼虫蚕皮经镍柱色谱纯化可获得大约 1 mg 的具有一定活性的人II型胶原蛋白,显示出杆状病毒-家蚕多基因表达系统可作为大规模生产表达活性人II型胶原蛋白和其他复杂真核蛋白的方法7。
昆虫杆状病毒表达系统的缺陷是:无法连续表达异源蛋白,无法产生复杂的糖基侧链等。
哺乳动物细胞表达体系是利用哺乳动物细胞进行瞬时或稳定表达,或将重组蛋白基因整合到寄主基因组中构建的转基因动物反应器。应用最广的细胞包括小鼠乳腺细胞、纤细肉瘤细胞和胚胎肾细胞。
John 等在转基因小鼠乳腺中表达了完全羟基化的重组胶原蛋白 (Mr = 60 kDa)。Toman 等在转基因小鼠乳腺内成功表达了可分泌、可溶性、具有螺旋结构的人I型原胶原同源三聚体 (Mr = 160 kDa),表达量高达 8 mg/mL。Hou 等在中国仓鼠卵巢内表达人VII型胶原蛋白 (Mr = 290 kDa)。多种人类细胞系,包括纤维肉瘤细胞 (HT-1080) 和胚胎肾细胞 (293- EBNA) 被成功用于制备重组人胶原蛋白I型、V型 (Mr = 120 和 250 kDa) 和VII型 (Mr = 290 kDa)。
目前细胞表达体系制备重组胶原蛋白因产量低不能满足工业规模生产的需求,对培养体系要求高,易受病毒感染。而转基因哺乳动物是重组人胶原蛋白可能的高产来源。
总结:重组胶原蛋白的核心工艺主要包括基因设计、细胞工程构建、发酵、分离纯化四个环节,各环节都存在技术难点:
(1)基因设计:通过基因编辑设计出序列如何组合,依照基因方案进行合成基因。
(2)细胞工程构建:选择宿主构建表达体系,主要包括动物、植物和微生物,将设计好的基因片段链接载体后载入工程细胞。构建具有高表达,高活性的重组DNA系统是各个厂家的核心技术。
(3)发酵:根据表达体系的不同,设置好相关的生产工艺,发酵流程是产能以及产量的关键。对发酵过程的优化调控至关重要,表达量直接影响了最终产量,如何实现高发酵水平是一大技术难点。
(4)分离纯化:即分离杂质和去除内毒素。分离纯化的方法多样,一般包括预处理、细胞破碎(胞内产物)、初纯、精纯和成品加工等步骤,其中细胞破碎环节会释放大量内毒素,少量内毒素进入人体血液就可引发发热、休克甚至死亡,因此内毒素的去除技术至关重要。回收率以及纯度直接影响产品的成本以及产品品质。
未交联的胶原蛋白在机械性能、力学性能以及相关物理化学性质偏弱,通过交联的方式增强其机械性能。目前常用的交联剂主要有化学、物理和生物交联三类。
1、化学交联
二醛淀粉(DAS)是一种大分子醛,潜在毒性非常低,可生物降解并具有抗病毒活性,DAS交联后的胶原的热稳定性能取决于DAS试剂与胶原的比例;低于饱和浓度的DAS可以防止胶原蛋白钙化。
2、物理交联
脱水加热(DHT)是一种交联胶原蛋白分子的简便方法。将胶原蛋白分子暴露在真空条件下的高温(>90°C)环境中除去水分子,胶原蛋白之间形成分子内链接(酰胺键)。由于 DHT 不需要任何化学试剂,因此该工艺不会产生细胞毒性,还能起到杀菌作用。与化学方法类似,DHT 也能改善胶原蛋白的机械性能。这些结构变化原则上会导致蛋白质失去生物活性,但变性可能会减少炎症,增加细胞在体内的附着力。
紫外线诱导的交联反应比DHT治疗更迅速、更有效。通过在酪氨酸和苯丙氨酸的芳香基团上形成自由基,自由基之间相互作用并形成化学键。与 DHT 相似,紫外线交联不需要任何额外的、可能具有细胞毒性的试剂,但也会导致胶原蛋白部分变性。值得注意的是,由于254nm的紫外线会破坏微生物的遗传物质,因此这种方法具有很强的杀菌效果。此外,研究发现,紫外线与光活化试剂的组合使用可能会更有效果。如与核黄素联用可用于眼部组织治疗等。
3、生物交联
使用酶修饰胶原蛋白够保持胶原蛋白的稳定性、弹性和生物活性,可使形成的复合材料具有更强的机械性能以及对成纤维细胞、人脐静脉内皮细胞和人冠状动脉平滑肌细胞的细胞相容性。常用的有赖氨酸氧化酶(LOX)、转谷氨酰胺酶(MTG)等。
参考文献:
[1]何会霞. 重组胶原蛋白及其生物材料的制备和性质研究[D].兰州大学,2023.
医疗器械、新材料、人工智能;
一定技术壁垒



