
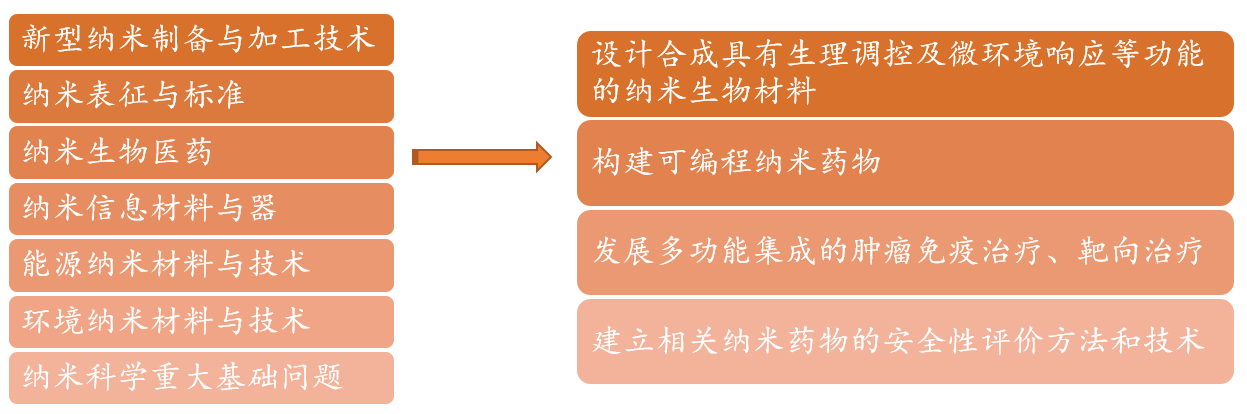
a 科技部、教育部、中国科学院等部门为继续保持我国在纳米科技国际竞争中的优势,并推动相关研究成果的转化应用,按照《国家中长期科技发展规划纲要(2006-2020)》部署,根据国务院《关于深化中央财政科技计划(专项、基金等)管理改革的方案》发布了“纳米科技”重点专项2020年度项目申报指南,国拨经费总概算7500万元,拟优先支持新型纳米制备与加工技术、纳米表征与标准、纳米生物医药、纳米信息材料与器件、能源纳米材料与技术、环境纳米材料与技术6个研究方向(如图12)。
其中,在纳米生物医药方向设置的研究课题为靶向肿瘤转移关键网络节点分子的可编程纳米药物。其研究内容包括:针对乳腺癌、结直肠癌和胰腺癌等的转移复发,结合肿瘤转移发生发展的动力学、表观遗传学和代谢组学特征,设计合成具有原位组装、生理调控及微环境响应等功能的纳米生物材料;构建可编程纳米药物,研究其阻断肿瘤转移的免疫和代谢等多层次信号通路,抑制肿瘤细胞侵袭、迁移,调控休眠肿瘤干细胞干性,逆转肿瘤转移微环境,并从系统生物学和系统医学的角度揭示其分子机制;发展多功能集成的肿瘤免疫治疗、靶向治疗新策略;建立相关纳米药物的安全性评价新方法和新技术。
《关于深化中央财政科技计划(专项、基金等)管理改革的方案》[1]
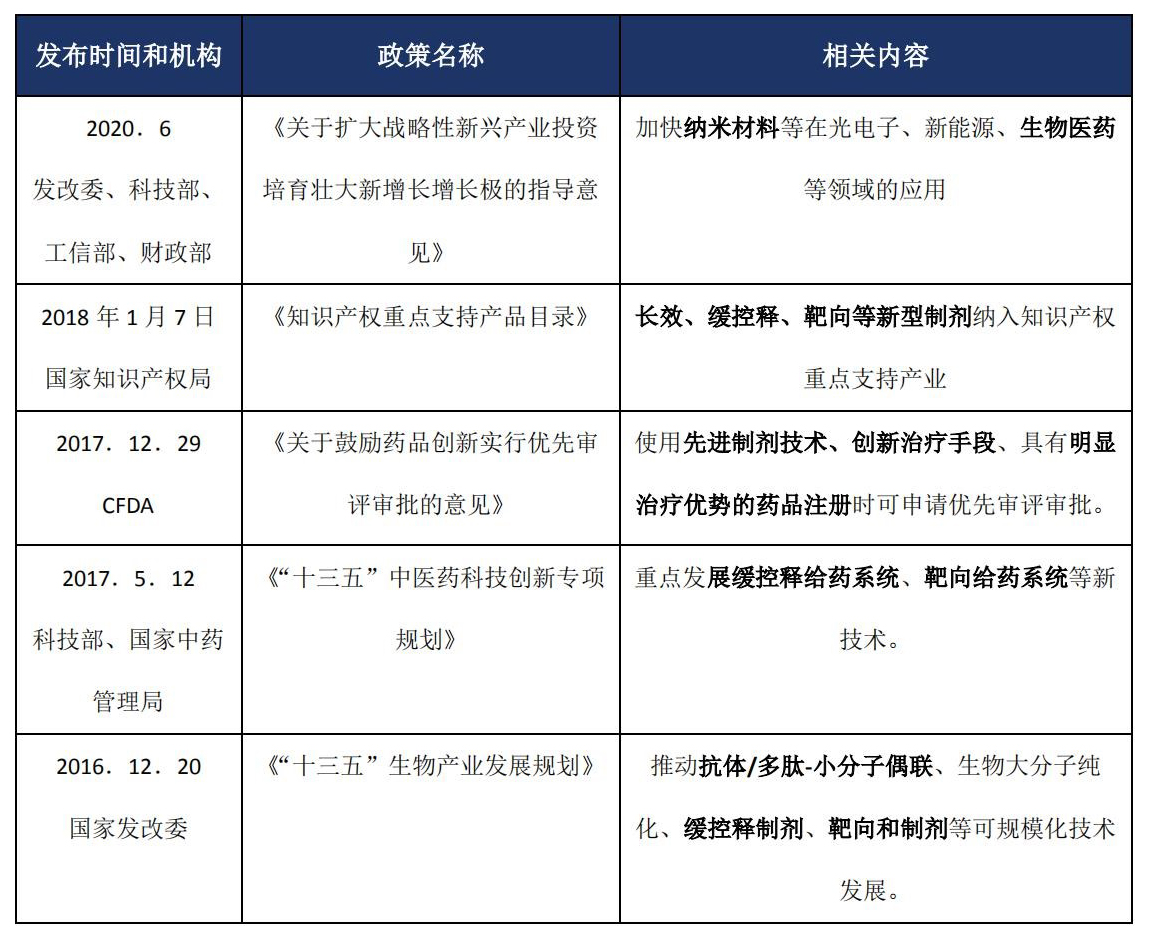
b 与纳米药物相关的其他政策梳理[2]
聂广军,中科院特聘研究员,国科大特聘教授;科技部纳米研究国家重大科学研究计划(973)项目首席科学家(2012-2016),国家重点研发计划首席科学家(2018-2022);国务院享受政府特殊津贴专家;基金委创新群体、中科院创新交叉团队、中科院卢嘉锡国际团队成员;2016年获中国药学会以岭药业青年科学家奖,美国Houston Methodist Research Institute(休斯敦)兼职教授,英国医学科学院Advanced Newton Scholar;中国生物物理学会常务理事,中国抗癌协会纳米肿瘤学专业委员会委员,中国药学会纳米药物专业委员会委员;国家纳米科学中心科技处处长;Nano Letters 副主编。
科研领域:
团队研究领域主要包括肿瘤纳米生物学、纳米生物技术和纳米生物效应等。
主要从事的研究方向包括:
肿瘤微环境调控的智能纳米药物;
膜泡系统的纳米生物效应和药物递送;
生物分子指导的功能性纳米材料设计、构筑和自组装;
发展基于纳米技术和生物技术的代谢疾病和退行性疾病的新型治疗策略。
代表性成果:
♦ 基于天然蛋白质—分子伴侣GroEL的结构和功能特点装载疏水药物多柔比星,通过响应肿瘤微环境中的高浓度ATP,实现肿瘤特异性的触发释放药物,杀伤肿瘤细胞[4](如图1)。
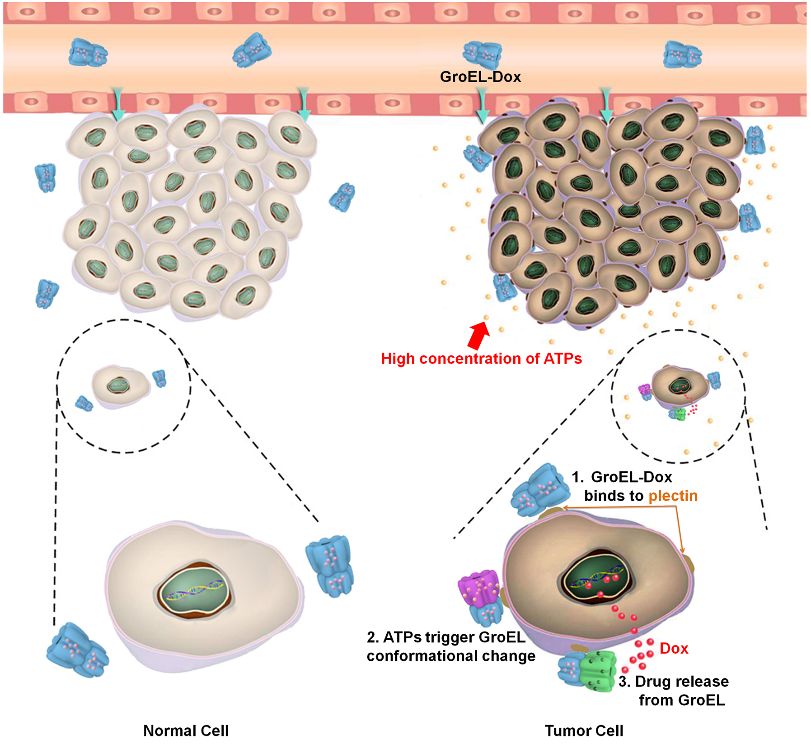
图1 GroEL运载多柔比星(Dox),靶向肿瘤细胞,并由ATP激发释放药物
♦ 针对血栓溶栓阿替普酶(rt-PA)治疗过程中的核心问题,提出利用血小板膜纳米颗粒搭载溶栓药物的策略,改善rt-PA的药代动力学,优化药效动力学,降低了潜在的出血风险[5](如图2)。
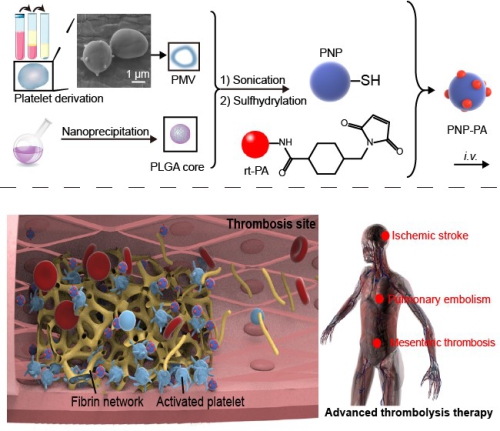
图2 血小板膜纳米颗粒搭载阿替普酶,实现急性血栓性疾病的广谱溶栓治疗
♦ 研发具有靶向功能的自组装多肽纳米体系,同时递送化疗药吉西他滨与Olaparib,对BRCA突变型胰腺癌显示出较强的抑制效果。后基于胰腺癌高特异性表面分子标志物(plectin-1),构建高效靶向性自组装多肽纳米载体,靶向递送DNA单链损伤修复抑制剂Olaparib和DNA双链损伤修复抑制剂JQ1(如图3)[6]。
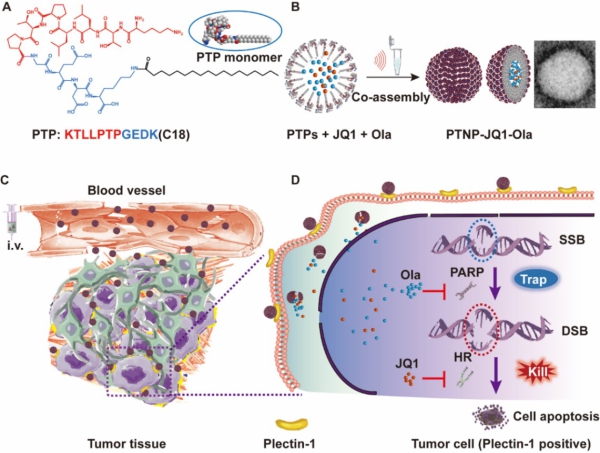
图3 JQ1的“诱捕”与“杀伤”的策略
♦ DNA折纸技术(详细内容在最后一部分)
纳米技术及应用国家工程研究中心是我国政府在布局国家发展纳米科技与产业方面专门设立的、国内唯一一所从事纳米技术及应用研究的国家级工程研究中心。由上海交通大学、复旦大学、华东师范大学、中科院上海微系统与信息技术研究所等十家发起单位共同出资组建。
⑴ 应用研究与服务平台
应用研究与服务平台涉及纳米生物医学工程研究所、纳米生物与医学技术研究所、纳米能源材料与技术研究所、纳米功能材料与技术研究所、纳米信息与表面技术研究所、纳米环境材料与技术研究室、分析测试服务部、上海湖泊河道污染控制与修复中心这8大板块。
♦ 纳米生物医学工程研究所
纳米材料的制备、修饰、自组装 (包括量子点、超顺磁性纳米微球、胶体金及金纳米棒、树形分子、碳纳米管及生物可降解材料、特殊功能的核酸与蛋白质材料的制备、分离、纯化)纳米材料的制备、修饰、自组装 (包括量子点、超顺磁性纳米微球、胶体金及金纳米棒、树形分子、碳纳米管及生物可降解材料、特殊功能的核酸与蛋白质材料的制备、分离、纯化)
♦ 纳米生物与医药技术研究室
生物医用材料:生物材料(如骨填充材料、多孔支架、软组织植入物)制备技术,生物材料表面改性和修饰技术,量子点的制备与修饰技术,以及生物医用材料的安全性评价;
纳米诊疗技术:纳米药物载体制备技术,药物载体靶向修饰技术,药物缓释和控释技术;组织特异性造影剂的制备技术,造影剂靶向修饰技术,基于功能化纳米材料的分子影像技术,以及药物医用材料的安全性评价;
⑵ 专利情况—何丹农 颜娟 胡冲娅 金彩虹
♦ 利用 DAPI嵌入和释放模拟 DNA纳米折纸结构作为药物载体的方法
通过DAPI嵌入DNA纳米折纸结构后荧光强度的增强以及DNA纳米折纸结构降解后释放DAPI导致的荧光强度下降模拟 DNA 纳米折纸结构作为抗肿瘤药物载体的药物负载及缓释过程。
♦ 利用DNA折纸结构构建级联反应的方法(级联酶)
一种利用DNA折纸将级联酶分别放在两种不同位点构建级联反应的方法,精确调控级联酶的间距,提高级联的效率。
♦ 基于滚环扩增和DNA折纸术检测microRNA
利用滚环扩增对所检测核酸进行信号放大,随后利用DNA折纸术对扩增后的长链进行有序的折叠,通过订书钉链引入检测序列,从而实现对miRNAs的含量进行测定。
潘林强,华中科技大学自动化学院副院长、华中学者特聘教授,兼任湖北省运筹学学会理事长。主要从事生物计算及其相关的DNA纳米技术和人工智能,主持了国家自然科学基金重点项目1项、国家自然科学基金重大国际合作项目1项、国家自然科学基金面上项目7项、国家重点研发计划项目1项,担任Journal of Membrane Computing杂志主编。
专利情况
♦ 一种基于船状DNA折纸的纳米载药系统
系统包括:船状DNA折纸主体,位于该船状DNA折纸主体凹槽部位且伸出的捕捉链,位于该船状DNA折纸主体凹槽部位的凝血酶,位于该船状DNA折纸主体两端且伸出的靶向链,以及固定在靶向链上用于靶向识别核仁素的靶向适配体。其中,凝血酶表面修饰有连接链,连接链用于与捕捉链相结合,船状DNA折纸主体是由一条M13 环形单链经订书针链结合而构成的(如图4所示)。
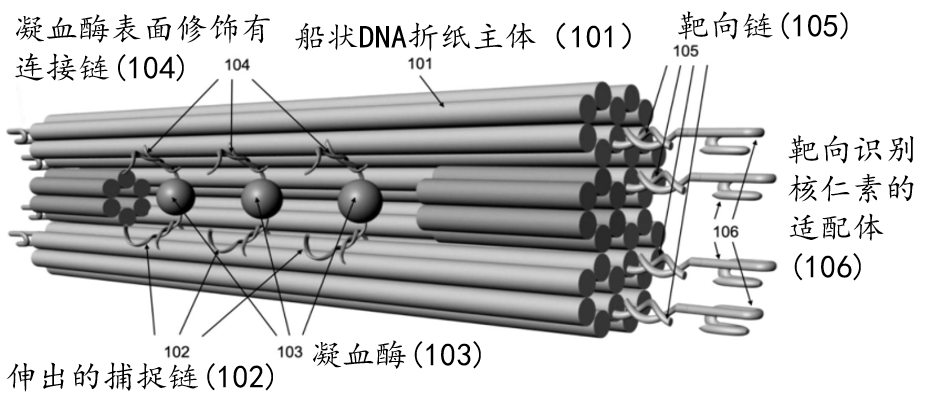
图4 船状DNA折纸的纳米载药系统
♦ DNA折纸结构、其闭合和释放方法及作为药物载送系统应用
DNA折纸结构为DNA四面体,含有三个三角形折纸和中心三角形折纸,骨架链均为M13 噬菌体的环状单螺旋DNA链,通过各自内部订书钉链与各自骨架链进行碱基互补配对而咬合;中心三角形折纸通过捕获链来捕获纳米金颗粒,提高了药物的装载效率(如图5所示)。
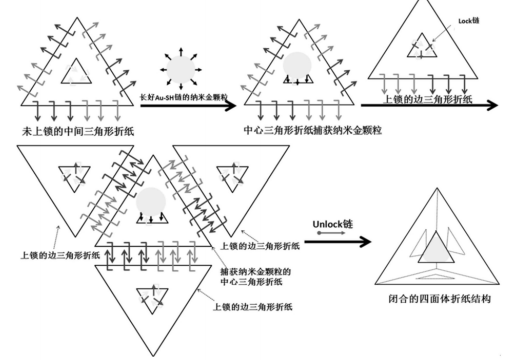
图5 四面体DNA折纸闭合系统
施剑林,中国科学院上海硅酸盐研究所研究员,中国科学院院士。曾任上海硅酸盐研究所所长,高性能陶瓷与超微结构国家重点实验室主任。主要从事新型纳米催化剂的可控制备与生物医学应用;介孔与其他无机纳米材料的设计、可控合成及物化性能;基于无机纳米结构的药物输运与诊疗一体化。提出了“纳米催化医学”的全新研究前沿方向,使用无毒纳米颗粒而不使用传统的有毒化疗药物,通过引发瘤内原位的催化反应达到抗肿瘤目的。
科研动态:
♦ 肿瘤内纳米螯合物的原位合成和肿瘤高效催化治疗[10]
通过将Dox(抗肿瘤药物)和2DG(一种葡萄糖类似物,用于抗糖酵解剂)封装在一个单一的纳米系统中,一方面对于肿瘤,2DG饥饿肿瘤从而降低肿瘤耐药性,同步递送的Dox会因为饥饿肿瘤后,然后进一步放大其毒性;另一方面,对于正常细胞,因为2DG会使得正常细胞同样处于饥饿状态,而这恰恰可以让正常细胞接触到该纳米系统时,开启了自我保护状态,从而大大降低了化疗药物对正常组织的伤害(如图6)。
图6脂质体纳米药物及其与癌细胞和正常细胞的相互作用
♦ 磁热疗联合免疫治疗原发性和转移性肿瘤[11]
通过合成了单分散的高性能超顺磁性CoFe2O4@MnFe2O4纳米颗粒,将其用于有效的联合磁热诱导原发性肿瘤热消融。同时,产生了许多肿瘤相关抗原,以促进树突状细胞(DCs)和细胞毒性T细胞的成熟和活化(如图7所示)。

图7 超顺磁性CoFe2O4@MnFe2O4纳米颗粒的示意图及作用机制
上海交通大学化学化工学院王宽诚讲席教授,中国科学院院士。2004年以来,先后入选中国科学院百人计划,国家杰出青年基金资助。2012-2016年任科技部纳米973首席科学家,入选美国科学促进会(AAAS)、国际电化学学会(ISE)和英国皇家化学会(RSC)会士,2019年当选中国科学院院士。研究方向涉及生物传感与成像、DNA纳米技术与DNA计算、生物光子学,主要研究成果包括:DNA折纸术、DNA编程组装、药物载体以及等离基元纳米光学。
科研动态:
♦ 核酸框架体作为程序化载体用于经皮肤给药[12]
设计不同形状和大小的核酸框架体(FNAs),研究了它们对小鼠和人类皮肤外植体的穿透性(如图8)。

图8 核酸框架下的药物包载及释放
♦ 磁性DNA纳米爪模仿病毒捕获细胞[13]
开发了具有章鱼臂形态的杂价磁性DNA纳米爪,可以装载针对不同抗原表位的多抗体,增强对癌细胞的捕获,特别是显著提高了捕获效率(如图9所示)。

图9 磁性DNA纳米爪示意图
参考资料:
[1]“纳米科技”重点专项2020年度项目申报指南(征求意见稿)
[2] 各政府部门官方网站,中信证券研究部
[3] 国家纳米科学中心
[4] Yuan Y , Du C , Sun C , et al. Chaperonin-GroEL as a Smart Hydrophobic Drug Delivery and Tumor Targeting Molecular Machine for Tumor Therapy[J]. Nano Letters, 2017:acs.nanolett.7b04307.
[5] Xu J , Zhang Y , Xu J , et al. Engineered Nanoplatelets for Targeted Delivery of Plasminogen Activators to Reverse Thrombus in Multiple Mouse Thrombosis Models[J]. Advanced Materials, 2019, 32(4):1905145.
[6] Wang Y , Du C , Zhao Y , et al. Trap and kill strategy for non-BRCA mutant pancreatic cancer by co-delivery of olaparib and JQ1 with plectin-1 targeting peptide nanoparticles[J]. Nano Today, 2020, 33:100877.
[7] 纳米技术及应用国家工程研究中心官网
[8] 华中科技大学官网
[9] 中国科学院官网
[10] Yang B , Chen Y , J Shi. Tumor‐Specific Chemotherapy by Nanomedicine‐Enabled Differential Stress Sensitization[J]. Angewandte Chemie International Edition, 2020, 59(24).
[11] Combined Magnetic Hyperthermia and Immune Therapy for Primary and Metastatic Tumor Treatments[J]. ACS nano, 14(1):1033-1044.
[12] Wiraja C , Zhu Y , Lio D , et al. Framework nucleic acids as programmable carrier for transdermal drug delivery[J]. Nature Communications, 2019, 10(1).
[13] Wang Z , Qin W , Zhuang J , et al. Virus-Mimicking Cell Capture Using Hetero-Valency Magnetic DNA Nano-Claws[J]. ACS Applied Materials & Interfaces, 2019.
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正。
文章来源:和义广业创新平台
医疗器械、新材料、人工智能;
一定技术壁垒



