纳米药物5——肿瘤疫苗?仿生导弹?未来发展与挑战并存!
发布时间:2021-11-22 09:15:41浏览次数:
纳米药物的应用广泛,主要通过几个典型的例子(包括DNA折纸技术、纳米“仿生导弹”和纳米颗粒疫苗)来详细说明。
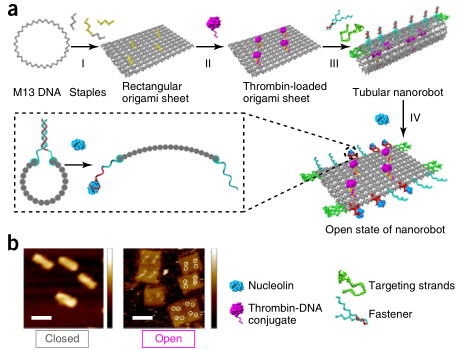
DNA折纸是一种能够合理设计和生产DNA纳米结构的方法,它对其大小、形状和空间均有准确的控制[1]。利用DNA折纸来构建一个能够克服凝血酶运送不确定的DNA纳米机器人,它可以控制凝血酶的释放,直到与肿瘤血管标记物相互作用触发。
这一药物递送的DNA折纸技术其构建过程如下所示[2]:
a 带有M13噬菌体单链DNA(黑色)和短链的矩形DNA折纸结构(青色);
b 这一部分的功能链包括:用于滚动管折纸纳米结构的紧固件(红色和蓝色)、用于装载货物的捕获链、用于靶向递送的附加适配子链(绿色)、用于成像的荧光染料标记链(ssDNA序列,品红)以及12条凝血酶负荷链(黄色);
c 短链被重新配置,形成四个底部侧凝血酶- DNA结合位点(紫色)。红色的线是紧固件,绿色的是额外的目标序列(如图1和图2)。
a DNA 分子间遵循严格的Watson-Crick碱基互补配对原则,这使得DNA纳米结构具有较强的可预测性,可以根据需要预先设计精确可控的尺寸和形状;
b 由于DNA 分子具有在体外比较稳定且易于被修饰等特点,理论上可以将任何连接DNA分子上的物质基团通过链杂交的方式连接到DNA纳米结构上;
c 固相合成技术以及分子生物学技术的发展使得体外大量获得任意序列的DNA分子变得越来越容易,成本也在不断下降,使得DNA纳米载体技术的规模化应用成为可能。
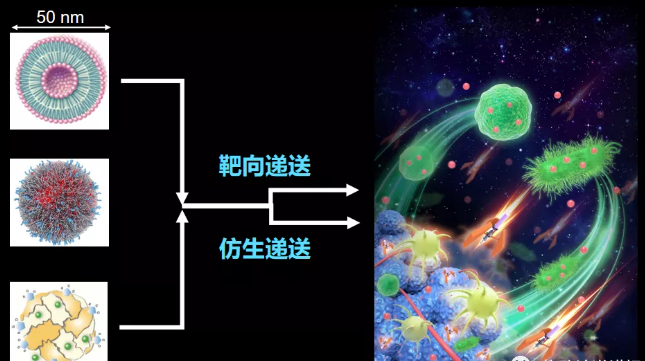
目前已经有很多种针对肿瘤的治疗技术,比如手术、放疗和化疗、细胞的免疫学治疗等。每种治疗模式采用的手段不一样,成功率也是不同的。而纳米药物能够提供更安全、高效、有序的治疗方式(如图3)。在图片左上方这个只有50nm的纳米球可以把药物和光敏分子包在这个体系里,在体内运行的过程中,自动地找到需要治疗的肿瘤部位,起到了神奇的“邮递员”的作用。同时,也可以把纳米材料附在活细胞、细菌上面,达到仿生的治疗功能。
纳米仿生导弹在医学诊疗涉及的学科领域非常宽广,一方面具有靶向性,另一方面可视化。
制作的纳米药物发挥作用的方式有两种:一方面,由于肿瘤部位生长得非常快,所以它的血管和组织是个渗漏的体系,在血管和组织之间有很多空穴、狭缝。当纳米材料在体内循环的时候,纳米材料就会卡在血管组织的缝隙里,所以肿瘤细胞会越吸越多。这是一个完全被动的过程(如图4左);另一方面,纳米表面上修饰很多生物识别的分子,分子的作用与古建筑中榫卯的结构类似,它会固定并抓住病灶细胞,利用这样的方式,很容易把药物递送到肿瘤组织上去,发挥重要的作用,即“分子靶向递送”的作用(如图4右)。
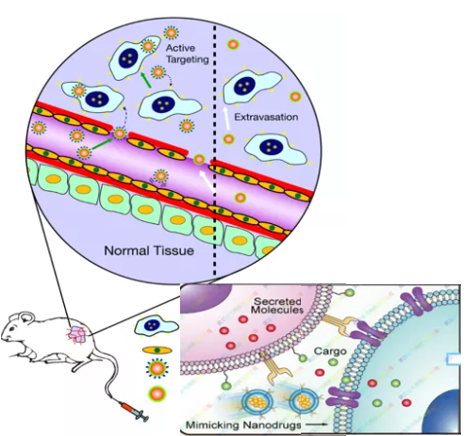 图4 正常组织的血管致密与肿瘤组织的血管渗漏(左)、分子识别、靶向递送(右)
纳米药丸里的光敏剂是能激发荧光和光热治疗的。它是一个可视化的治疗模式,比如能看到肿瘤是否消除、药物的富集和去除等过程。以小鼠为例说明,在图5中绿色亮光处就是小鼠的肿瘤部位,说明这个地方有肿瘤,后半部分是看到了肿瘤之后,用激光去照射释放药物后小鼠的热成像。这种方式能够非常精准地治疗肿瘤,也不会破坏其他的器官和组织。
根据肿瘤细胞和细菌的细胞结构,利用纳米技术,将含有肿瘤抗原信息的肿瘤细胞膜(tumor membrane,TMs)和含有佐剂信息的细菌内膜(大肠杆菌胞质膜(E. coli cytoplasmic membranes,EMs))展示于聚合物纳米颗粒表面,制备成个性化的杂合膜纳米肿瘤疫苗(HM- NPs)。这种疫苗中的细菌膜成分可以向机体免疫系统提供外源的“危险信号”,使得源于患者“自体”的肿瘤膜能够一起被认为是危险入侵者进而高效的被树突状细胞摄取,从而提高肿瘤抗原的递送和呈递效率(如图6)。
♦ HM-NPs能够增强肿瘤抗原摄取的能力,激活Toll样受体(Toll-like receptors ,TLRs),识别病原相关分子并激活免疫反应,同时将抗原和佐剂传递给骨髓来源的树突状细胞。
♦ HM-NPs促进淋巴结中DC的成熟并激活小鼠的TM抗原特异性T细胞。
♦ HM-NPs诱导轻微的炎症反应(IL-6、IL-1β、TNF-α等)。
♦ HM-NP疫苗在多种小鼠肿瘤模型中抑制肿瘤复发。
20世纪90年代,随着纳米技术的繁荣发展和相关倡议的提出,人们更加关注纳米药物的生产、材料的控制以及含有纳米材料药品的最终商业影响。
需要将纳米颗粒与其递送的药物和特定的肿瘤(适应症)相匹配,通过对纳米材料的理性设计和合成,考量药物-器械相互作用、产品稳定性、ADME考虑因素和局部考虑因素等对含有纳米材料药品的质量、安全性和/或有效性的影响。含纳米材料的药品最常见的给药途径是通过肠外途径。
需要专门的分析方法来表征纳米材料,表征方法在确定纳米药物稳定的质量方面发挥着关键作用;应确定用于检测的分析程序的准确度/灵敏度/特异性和重现性标准,并适合预期目的;CDER参与包含纳米材料的药物产品的标准开发,以确保向公司和CROs提供文件标准和SRMs(ASTM、ISO标准)。
任何产品的毒性以及不良反应,都因情况而异。例如,具有较高半衰期的持久性纳米颗粒不容易从体内消除,而且往往具有较高的不良影响。因此需要严格的监管评估[5]。根据国际标准制定机构的规定,以纳米颗粒为基础的配方要求的最小测量值包括尺寸、zeta电位和溶解度。由于纳米药物的尺寸非常小,它们直接与生物表面相互作用,产生自由基,导致细胞死亡,因此,需要严格的临床评估以最大限度地减少纳米药物的不良影响[6]。
药物(纳米)的研发不仅耗时长而且花费大,Tufts中心在药物研发方面的研究发现临床试验阶段的费用基本在10亿 – 17亿美元[7]。在纳米颗粒复杂和多组分的情况下,由于其与生物膜之间的相互作用以及较高的开发成本导致很难确定纳米药物关键质量的属性[8]。
体外细胞学和动物学评估。纳米药物的体内性能包括药物代谢动力学、生物分布、生物相容性和生物安全性等,上述性能必须通过动物模型进行准确评估。但是在纳米药物研发过程中能准确反映人类癌症病症的动物实验模型缺乏。药代动力学模型的构建也很重要。所以研究可以聚焦在产品、产品的分类、围绕纳米药物产品的一般性问题,如质量的考量、药理学、毒理学构建模型,研究耐用的纳米材料、复杂药物的等效性。
纳米药物的商业化主要取决于以产品安全和质量为基础的监管机构[9]。但是,许多监管机构仍然缺乏明确而简明的纳米颗粒开发和临床转化的安全指南。
大规模和重复性地制备可能会伴随配方参数的优化,甚至工艺的改变。如纳米混悬液的制备方法大致分为“自上而下”和“自下而上”方法,制作过程中使用包括有机溶剂、离心、高速均质、交联、冻干等,在放大过程中需要特别考虑这些参数,因为这些参数可能会变化,从而导致关键属性的限制无法接受[10]。
[1] Chen, Y.J., Groves, B., Muscat, R.A. & Seelig, G. DNA nanotechnology from the test tube to the cell. Nat. Nanotechnol. 10, 748–760 (2015).
[2] [1] Li S , Qiao J , Liu S , et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger[J]. Nature Biotechnology, 2018, 36(3).
[3] 资料来自中国科学院计算机网络信息中心与中国科学院科学传播局联合主办的科学文化讲坛
[4] Chen L, Qin H, Zhao R, Zhao X, Lin L, Chen Y, Lin Y, Li Y, Qin Y, Li Y, Liu S, Cheng K, Chen H, Shi J, Anderson GJ, Wu Y, Zhao Y, Nie G. Bacterial cytoplasmic membranes synergistically enhance the antitumor activity of autologous cancer vaccines. Sci Transl Med. 2021 Jul 7;13(601):eabc2816.
[5] N. Desai, Challenges in development of nanoparticle-based therapeutics, AAPS J.14 (2012) 282–295.
[6] B. Smolkova, M. Dusinska, A. Gabelova, Nanomedicine and epigenome. Possible health risks, Food Chem. Toxicol. 109 (2017) 780–796.
[7] J.A. DiMasi, H.G. Grabowski, R.W. Hansen, Innovation in the pharmaceutical industry: new estimates of R&D costs, J. Health Econ. 47 (2016) 20–33.
[8] J.I. Hare, T. Lammers, M.B. Ashford, S. Puri, G. Storm, S.T. Barry, Challenges and strategies in anti-cancer nanomedicine development: an industry perspective,Adv. Drug Deliv. Rev. 108 (2017) 25–38.
[9] V. Sainz, J. Conniot, A.I. Matos, C. Peres, E. Zupancic, L. Moura, L.C. Silva, H.F. Florindo, R.S. Gaspar, Regulatory aspects on nanomedicines, Biochem.Biophys. Res. Commun. 468 (2015) 504–510.
[10] R. Paliwal, R.J. Babu, S. Palakurthi, Nanomedicine scale-up technologies:feasibilities and challenges, AAPS PharmSciTech 15 (2014) 1527–1534.
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正。
图4 正常组织的血管致密与肿瘤组织的血管渗漏(左)、分子识别、靶向递送(右)
纳米药丸里的光敏剂是能激发荧光和光热治疗的。它是一个可视化的治疗模式,比如能看到肿瘤是否消除、药物的富集和去除等过程。以小鼠为例说明,在图5中绿色亮光处就是小鼠的肿瘤部位,说明这个地方有肿瘤,后半部分是看到了肿瘤之后,用激光去照射释放药物后小鼠的热成像。这种方式能够非常精准地治疗肿瘤,也不会破坏其他的器官和组织。
根据肿瘤细胞和细菌的细胞结构,利用纳米技术,将含有肿瘤抗原信息的肿瘤细胞膜(tumor membrane,TMs)和含有佐剂信息的细菌内膜(大肠杆菌胞质膜(E. coli cytoplasmic membranes,EMs))展示于聚合物纳米颗粒表面,制备成个性化的杂合膜纳米肿瘤疫苗(HM- NPs)。这种疫苗中的细菌膜成分可以向机体免疫系统提供外源的“危险信号”,使得源于患者“自体”的肿瘤膜能够一起被认为是危险入侵者进而高效的被树突状细胞摄取,从而提高肿瘤抗原的递送和呈递效率(如图6)。
♦ HM-NPs能够增强肿瘤抗原摄取的能力,激活Toll样受体(Toll-like receptors ,TLRs),识别病原相关分子并激活免疫反应,同时将抗原和佐剂传递给骨髓来源的树突状细胞。
♦ HM-NPs促进淋巴结中DC的成熟并激活小鼠的TM抗原特异性T细胞。
♦ HM-NPs诱导轻微的炎症反应(IL-6、IL-1β、TNF-α等)。
♦ HM-NP疫苗在多种小鼠肿瘤模型中抑制肿瘤复发。
20世纪90年代,随着纳米技术的繁荣发展和相关倡议的提出,人们更加关注纳米药物的生产、材料的控制以及含有纳米材料药品的最终商业影响。
需要将纳米颗粒与其递送的药物和特定的肿瘤(适应症)相匹配,通过对纳米材料的理性设计和合成,考量药物-器械相互作用、产品稳定性、ADME考虑因素和局部考虑因素等对含有纳米材料药品的质量、安全性和/或有效性的影响。含纳米材料的药品最常见的给药途径是通过肠外途径。
需要专门的分析方法来表征纳米材料,表征方法在确定纳米药物稳定的质量方面发挥着关键作用;应确定用于检测的分析程序的准确度/灵敏度/特异性和重现性标准,并适合预期目的;CDER参与包含纳米材料的药物产品的标准开发,以确保向公司和CROs提供文件标准和SRMs(ASTM、ISO标准)。
任何产品的毒性以及不良反应,都因情况而异。例如,具有较高半衰期的持久性纳米颗粒不容易从体内消除,而且往往具有较高的不良影响。因此需要严格的监管评估[5]。根据国际标准制定机构的规定,以纳米颗粒为基础的配方要求的最小测量值包括尺寸、zeta电位和溶解度。由于纳米药物的尺寸非常小,它们直接与生物表面相互作用,产生自由基,导致细胞死亡,因此,需要严格的临床评估以最大限度地减少纳米药物的不良影响[6]。
药物(纳米)的研发不仅耗时长而且花费大,Tufts中心在药物研发方面的研究发现临床试验阶段的费用基本在10亿 – 17亿美元[7]。在纳米颗粒复杂和多组分的情况下,由于其与生物膜之间的相互作用以及较高的开发成本导致很难确定纳米药物关键质量的属性[8]。
体外细胞学和动物学评估。纳米药物的体内性能包括药物代谢动力学、生物分布、生物相容性和生物安全性等,上述性能必须通过动物模型进行准确评估。但是在纳米药物研发过程中能准确反映人类癌症病症的动物实验模型缺乏。药代动力学模型的构建也很重要。所以研究可以聚焦在产品、产品的分类、围绕纳米药物产品的一般性问题,如质量的考量、药理学、毒理学构建模型,研究耐用的纳米材料、复杂药物的等效性。
纳米药物的商业化主要取决于以产品安全和质量为基础的监管机构[9]。但是,许多监管机构仍然缺乏明确而简明的纳米颗粒开发和临床转化的安全指南。
大规模和重复性地制备可能会伴随配方参数的优化,甚至工艺的改变。如纳米混悬液的制备方法大致分为“自上而下”和“自下而上”方法,制作过程中使用包括有机溶剂、离心、高速均质、交联、冻干等,在放大过程中需要特别考虑这些参数,因为这些参数可能会变化,从而导致关键属性的限制无法接受[10]。
[1] Chen, Y.J., Groves, B., Muscat, R.A. & Seelig, G. DNA nanotechnology from the test tube to the cell. Nat. Nanotechnol. 10, 748–760 (2015).
[2] [1] Li S , Qiao J , Liu S , et al. A DNA nanorobot functions as a cancer therapeutic in response to a molecular trigger[J]. Nature Biotechnology, 2018, 36(3).
[3] 资料来自中国科学院计算机网络信息中心与中国科学院科学传播局联合主办的科学文化讲坛
[4] Chen L, Qin H, Zhao R, Zhao X, Lin L, Chen Y, Lin Y, Li Y, Qin Y, Li Y, Liu S, Cheng K, Chen H, Shi J, Anderson GJ, Wu Y, Zhao Y, Nie G. Bacterial cytoplasmic membranes synergistically enhance the antitumor activity of autologous cancer vaccines. Sci Transl Med. 2021 Jul 7;13(601):eabc2816.
[5] N. Desai, Challenges in development of nanoparticle-based therapeutics, AAPS J.14 (2012) 282–295.
[6] B. Smolkova, M. Dusinska, A. Gabelova, Nanomedicine and epigenome. Possible health risks, Food Chem. Toxicol. 109 (2017) 780–796.
[7] J.A. DiMasi, H.G. Grabowski, R.W. Hansen, Innovation in the pharmaceutical industry: new estimates of R&D costs, J. Health Econ. 47 (2016) 20–33.
[8] J.I. Hare, T. Lammers, M.B. Ashford, S. Puri, G. Storm, S.T. Barry, Challenges and strategies in anti-cancer nanomedicine development: an industry perspective,Adv. Drug Deliv. Rev. 108 (2017) 25–38.
[9] V. Sainz, J. Conniot, A.I. Matos, C. Peres, E. Zupancic, L. Moura, L.C. Silva, H.F. Florindo, R.S. Gaspar, Regulatory aspects on nanomedicines, Biochem.Biophys. Res. Commun. 468 (2015) 504–510.
[10] R. Paliwal, R.J. Babu, S. Palakurthi, Nanomedicine scale-up technologies:feasibilities and challenges, AAPS PharmSciTech 15 (2014) 1527–1534.
作者声明:感谢本文参考资料作者,文中观点仅供参考,不恰当之处还望包涵指正。